LWF Wissen 89
Genetisches Potential der Roteiche in Bayern
von Barbara Fussi, Jonas Eckel, Muhidin Šeho
Einbringung von Alternativbaumarten zur Erweiterung der Baumartenpalette
Der Klimawandel und dessen Folgen stellt die Forstwirtschaft und die Waldbesitzer aller Waldbesitzarten vor große Herausforderungen. Die Anzahl an heimischen Baumarten mit einer positiven Klimaprognose wird immer kleiner und sollte in Zeiten des Klimawandels erweitert werden. Mögliche Alternativbaumarten sollten Eigenschaften aufweisen, die unter den prognostizierten Klimabedingungen eine gute Stabilität und Wuchsleistung erwarten lassen. Das Ziel früherer Einbringungswellen war nach der mittelalterlichen Entwaldung den nachwachsenden Rohstoff Holz wieder vermehrt zu produzieren. Im Gegensatz dazu ist das Ziel der aktuellen Einbringung von Alternativbaumarten, labile Bestände mit trockenheitstoleranten zusätzlichen Baumarten zu stabilisieren bzw. wieder in Bestockung zu bringen. Dadurch sollen klimatolerante Waldbestände aufgebaut werden. Eine Baumart, die in vielen europäischen Ländern als eingeführt gilt und als Alternative genutzt werden soll, ist die Roteiche (Quercus rubra). Die Roteiche wurde bei früheren Einfuhrwellen nach Europa aus weitgehend unbekannten Quellen eingebracht und zunächst, wie viele andere nichtheimische Baumarten, als Parkbaum verwendet. In einigen Fällen wurden aus diesem Vermehrungsgut Waldbestände begründet. Bei der weiteren forstlichen Nutzung kann das dazu führen, dass Saatgut aus qualitativ nicht überzeugenden Beständen durch sehr hohen zeitlichen und finanziellen Aufwand durch Züchtungs- und Selektionsprozesse optimiert werden muss. Der Anbau von eingeführten Baumarten ist oft mit einer Reduktion der genetischen Variation verbunden (Dlugosh und Parker 2008), was negative Auswirkungen auf die Anpassungsfähigkeit einer Baumart haben kann. Erst nach über 100 Jahren Anbau der Roteiche in Deutschland wird mit Hilfe genetischer Analysen versucht, die Herkunft des Vermehrungsgutes zu identifizieren (Pettenkofer et al. 2019). In den letzten Jahren wurde zunehmend die Anpassungsfähigkeit verschiedener Herkünfte untersucht, um geeignete Herkünfte für den Waldumbau in Deutschland zu identifizieren (Kormann et al. 2023). Wie bei allen anderen Baumarten ist die Verwendung geeigneter Herkünfte entscheidend für den Anbauerfolg. Die Verfügbarkeit von hochwertigem und genetisch vielfältigem Vermehrungsgut ist von großer Bedeutung. In dem Projekt RubraSelect wurde die langfristige Auslese und Charakterisierung von hochwertigem Vermehrungsgut bei der Roteiche unter Berücksichtigung der Trockenstresstoleranz vorgenommen.
Im Rahmen der vorliegenden Arbeit erfolgte die erste genetische Analyse von fünf bayerischen Saatguterntebeständen. Es werden die genetischen Vielfaltsparameter sowie genetische Strukturen bewertet und verglichen. Des Weiteren ist der Fokus auf Saatgut und Vermehrung ausgerichtet, da bei eingeführten Baumarten diese Erkenntnisse oft fehlen. Das Kapitel Erhaltung und Nutzung beleuchtet die gesetzlichen Regelungen, die vorhandenen Saatgutquellen und Erhaltungsbestände sowie vorhandene Erkenntnisse zu Herkunftsunterschieden. Im Rahmen der bayerischen Herkunfts- und Verwendungsempfehlungen werden in drei Empfehlungsstufen Saatguterntebestände aus Deutschland, Frankreich, Österreich und Bulgarien empfohlen und können von Waldbesitzern genutzt werden.
Natürliche Verbreitung und Herkunft
Das große natürliche Verbreitungsgebiet von Quercus rubra liegt in den östlichen USA und dem angrenzenden Südosten Kanadas (Abbildung 1). Die Verbreitung von Quercus rubra reicht bis in Höhenlagen von 1.600 m in den südlichen Appalachen (u. a. Schenck 1939, Sander 1990), im nördlichen Teil des Verbreitungsgebiets jedoch deutlich weniger hoch bis 200 – 700 m (Tirmenstein 1991). Q. rubra kommt mit sehr unterschiedlichen klimatischen und edaphischen Bedingungen zurecht (Nagel 2015). Die jährlichen Niederschlagsmengen liegen zwischen 760 mm (Dreßel und Jäger 2002) im Nordwesten und 2.030 mm in den südlichen Appalachen, die Jahresmitteltemperaturen zwischen 4,5 und fast 16 °C (Sander 1990, Tirmenstein 1991, Thompson et al. 1999). Q. rubra erträgt sehr kalte Winter (Januar Mittel von – 14 °C) und sehr heiße Sommer (Juli-Mittel bis 26 °C) und bevorzugt eine mittlere Nährstoffversorgung in Unter- und Mittelhanglagen, sowie gut drainierte Ebenen und Täler. Ausgeprägt trockene oder staunasse Standorte werden in der Regel gemieden, die Besiedlung sehr trockener Standorte ist aber möglich (Desmarais 1998). Das beste Wachstum zeigt sie auf tiefgründigem, sandigem Lehm mit leicht saurem pH-Wert, sie wächst aber auch auf Lehm, Ton und sandigen bis kiesigen Böden (Nagel 2015). Im Vergleich zu den einheimischen Weißeichenarten weist sie eine kürzere Umtriebszeit (~ 80 – 120 Jahre) sowie einen geringeren Nährstoff- und Wasserbedarf auf (Nagel 2015).
Die Roteiche Q. rubra wurde Ende des 17. Jahrhunderts aus ihrem natürlichen Verbreitungsgebiet in zwei großen Anpflanzungswellen aus Nordamerika nach Europa gebracht (Houba 1887, Hickel 1932 in Pettenkofer et al. 2020). Nagel (2015) beschreibt den möglichen Ursprung der in Deutschland eingebrachten Herkünfte zunächst aus Alleen in Holland und Belgien nach 1900 (Nielsen 1956). Später erfolgte die Einbringung aus Wisconsin, Michigan, Pennsylvania und New York (Bauer 1953a) und aus höheren Lagen in North Carolina und Tennessee (Appalachen) (Schenck 1939).
 Zoombild vorhanden
Zoombild vorhanden
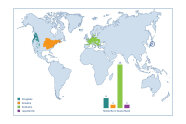
Abb. 1: Das natürliche Verbreitungsgebiet der Roteiche (orange) im Vergleich zu der natürlichen Verbreitung der Douglasie (petrol), Japanlärche (violett) und Rotbuche (grün). Für die meisten nichtheimischen Baumarten werden nur zwei Herkunftsgebiete ausgewiesen. Grafik: Šeho und Janßen 2019
Das natürliche Verbreitungsgebiet dieser Baumart ist sehr groß und von der Größe her mit dem natürlichen Verbreitungsgebiet der Rotbuche vergleichbar. Es werden jedoch wegen der geringen wirtschaftlichen Bedeutung, wie auch bei den meisten anderen nicht-heimischen Baumarten, nur zwei Herkunftsgebiete ausgewiesen (Abbildung 1). Um genetisch fixierte Anpassungsprozesse im natürlichen Verbreitungsgebiet zu berücksichtigen, sollten weitere trockentolerante Herkünfte untersucht und empfohlen werden.
Der erste Herkunftsversuch mit deutschen Bestandesabsaaten wurde 1956/58 an zwei Standorten in Südniedersachsen angelegt. Krahl-Urban (1966) fand deutliche, offensichtlich genetisch bedingte Unterschiede der untersuchten deutschen Bestände und gibt unter den damaligen Klimabedingungen die vorrangige Empfehlung, phänotypisch sehr gute deutsche Anbauten für die Saatgutversorgung heranzuziehen. Ein vergleichbarer Versuch in Schleswig-Holstein mit zahlreichen Herkünften aus dem natürlichen Verbreitungsgebiet und der deutschen Referenz-Herkunft »Bornheim« (Holthausen 1987) wird ähnlich interpretiert (Göckede 2010).
Ein Herkunftsversuch mit Pflanzgut von 15 amerikanischen und 12 europäischen, überwiegend deutschen Herkünften der Roteiche wurde 1991 auf drei Flächen angelegt (Liesebach und Schneck 2011). Auf den Flächen wurden die Überlebensraten, biotische und abiotische Schäden, sowie Höhen- und Durchmesserentwicklung aufgenommen. Nach 10 Jahren zeigen sich Unterschiede zwischen den Herkünften im Wachstum als auch in der Qualität. Die meisten europäischen Herkünfte übertreffen die originalen amerikanischen in der Wuchsleistung, nur die kanadischen Herkünfte könnten eine Mehrleistung gegenüber in Deutschland etablierten durchschnittlichen Beständen versprechen. Bei einer erneuten Auswertung der Versuche im Jahr 2023 wurden die Gefäßmerkmale als ökologische Indikatoren zur Untersuchung der Anpassungsfähigkeit verwendet. Dabei stellten Kormann et al. (2023) eine hohe Plastizität der Roteichen-Herkünfte in Bezug auf die lokalen Umweltbedingungen fest. Das Höhenwachstum der aus Deutschland stammenden Herkünfte lag über dem der eingeführten Originalherkünfte, insbesondere unter feuchten Bedingungen. Bei der Frosthärte erweisen sich eingeführte Provenienzen mit hoher Gefäßgröße als besser geeignet. Die im Rahmen dieser Arbeit identifizierten Generalisten/Spezialisten mit hohem Wachstum werden als vielversprechend für die Wiederaufforstung eingestuft. Für zukünftige Aufforstungen von trockenen Standorten sollten Saatgutimporte aus dem Norden des ursprünglichen Verbreitungsgebiets in Betracht gezogen werden (Kormann et al. 2023).
Versuchsanbauten mit Roteiche in Bayern wurden auf mehreren Standorten begründet und untersucht, dabei zeigte sich bisher eine überdurchschnittliche Höhenwuchsleistung bei vier Nachkommenschaften und eine unterdurchschnittliche Wuchsleistung bei drei Nachkommenschaften (Schirmer und Tubes 2024).
Saatgut und Vermehrung
Fruktifikation und Fortpflanzung
Roteichen sind einhäusige Pflanzen mit getrenntgeschlechtlichen Blüten. Die Bestäubung der weiblichen Blüten erfolgt dabei durch den Wind (Spethmann 2023). Die männlichen und weiblichen Blüten der Roteiche entwickeln sich in den Monaten April bis Mai, gleichzeitig oder kurz vor Beginn des Laubaustriebs (Suszka et al. 1994).
Die Roteiche beginnt ab einem Alter von 25 Jahren zu fruktifizieren, erreicht aber erst mit 50 Jahren den maximalen Fruchtertrag. Sie fruktifiziert alle zwei bis fünf Jahre (Suszka et al. 1994, Schopmeyer 1974). Die Witterung während der Blüte hat einen wesentlichen Einfluss auf die Samenbildung. Insbesondere Frost in dieser Zeit führt zu deutlich geringeren Samenerträgen (Auchmoody 1993, Gribko et al. 2002). Nach Gribko et al. (2002) weisen die Erntemengen eine sehr große Spanne von bis zu 600.000 Eicheln pro Hektar auf. Während die Eicheln der heimischen Eichen-Arten bis zum Herbst desselben Jahres wie die Blüte ausreifen, werden die Eicheln der Roteiche erst im Jahr danach reif (Suszka et al. 1994, Spethmann 2023).
Die Eichel selbst ist eine Nussfrucht, welche in einem Fruchtbecher (Cupula) sitzt (Spethmann 2023, Abbildung 2). Sie enthält den Embryo mit zwei dicken, fleischigen Keimblättern (Kotyledonen). Bei der Roteiche versorgen die dort enthaltenen Reservestoffe (Stärke) den Sämling für mehr als ein Jahr (Roloff 2013). Die Eicheln der Roteiche sind laut Burkardt (2017) im Vergleich zu denjenigen der heimischen Eichen größer und schwerer. Nach Suszka et al. (1994) sind die Eicheln der Roteiche regelmäßig zwischen 12 und 31 mm lang und haben einen Durchmesser von 12 bis 16 mm. Auffällig an ihren gedrungen-eiförmigen Früchten ist vor allem ihr flacher, am Rande wulstiger Fruchtbecher, der auf einem nur zwei bis drei Millimeter langem Stiel sitzt (www.artensteckbrief.de; Schenck 1939).
Die schwerfrüchtigen Eicheln werden in der Natur überwiegend durch Vögel und Kleinsäuger z. B. Mäuse verbreitet (Desmarais 1998, Gribko et al. 2002, Jensen und Nielson 1986). Der wichtigste Vektor ist in Europa der Eichelhäher (Garrulus glandularius) und in Nordamerika der amerikanische Blauhäher (Cyanocitta cristata) (Sork 1984, Darley-Hill und Carter Johnson 1981). Burkardt (2017) schreibt jedoch, dass die Roteichen weniger von den Eichelhähern verbreitet werden als die Eicheln der heimischen Eichen-Arten.
Die meisten Bestände der Roteiche werden durch Pflanzung oder Aussaat begründet, früher in Reinbeständen, heute als Gruppen in Mischbeständen (Nagel 2015). Mehrere Autoren gehen davon aus, dass sich in Roteichen-Mischbeständen eine höhere Qualität und Massenleistung als in Reinbeständen erreichen lässt und raten daher dazu, anders als früher üblich, Mischbestände zu begründen (Brun 1987, Erb 1987 und Mitscherlich 1957). In den Urwäldern ihres natürlichen Verbreitungsgebietes kommt die Roteiche auch meist nur in Mischbeständen vor (Schenck 1939). Für Bauer (1953) und Schulenburg (1966) ist eine hohe Pflanzenzahl bei der Bestandesbegründung notwendig, um eine gute Holzqualität zu erreichen. Die in der Literatur empfohlenen Pflanzzahlen schwanken jedoch stark: 3.000 – 4.000 Pflanzen/ha auf der Freifläche laut Asche et al. (2007), 7.000 – 8.000 Pflanzen/ha nach Eisenhauer et al. (2005).
Ernte und Klengung
Die Samenernte erfolgt bei der Roteiche in den Monaten Oktober und November (Mac Cárthaigh et al. 2023). Die Früchte können vom Boden aufgesammelt, mit einer Saugmaschine aufsaugt oder mittels Auslegens von Erntenetzen/Ernteplanen aufgefangen werden. Auch ein Einsatz von mechanischen Schüttlern ist möglich (Burkart 2018, Suszka et al. 1994).
 Zoombild vorhanden
Zoombild vorhanden
Abb. 2: Früchte der Roteiche. Foto: B. Fussi
Nach den ISTA-Regeln müssen die Eicheln für den Keimtest zunächst für 48 Stunden gewässert werden. Anschließend wird das untere Samenende abgeschnitten sowie die Samenschale (Perikarp) entfernt. Dann werden die Samen vier Wochen lang bei einer Temperatur von 20 °C leicht eingedrückt in feuchtem Quarzsand gekeimt (ISTA 2020).
Eine Auswertung der Saatgutprüfungen von insgesamt 55 Roteichenpartien der Reifejahre 2000 bis 2024, welche am AWG nach den ISTA-Regeln durchgeführt worden sind, ergab folgende Werte:
- Wassergehalt: durchschnittlich 36,4 %
- Keimfähigkeit: durchschnittlich 72,6 %
- Tausendkorngewicht: durchschnittlich 5.264 g
- Anzahl lebender Keime pro Kilogramm Saatgut: durchschnittlich 143,6 Stk.
Diese Saatgutprüfungen wurden zeitnah nach den Probeneingängen durchgeführt (Jenner 2025).
Lagerung und Stratifikation
 Zoombild vorhanden
Zoombild vorhanden
Abb. 3: Roteichen-Keimtests, nach 2 Wochen. Fotos: R. Jenner, AWG
Für die Einlagerung sollte nur Saatgut aus den besten Mastjahren verwendet werden, da in schwachen Mastjahren die Früchte oft mit (Rüssel-)Käfern (Curculio) befallen sind (Suszka et al. 1994, Spethmann 2023). Für eine vorübergehende Lagerung nach der Ernte können die Eicheln in einer maximal 15 cm starken Schicht auf dem Boden ausgestreut werden.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 4: Roteichen-Keimtests, nach 3 Wochen. Fotos: R. Jenner, AWG
Spethmann (2023) resümiert, dass alle Versuche, die in Frankreich, Deutschland, Dänemark und Polen zur Optimierung des bisher üblichen Lagerverfahrens zu dem Ergebnis kamen, dass eine Lagerung nur bis zu 18 Monaten Sinn mache. Am Institut für Obstbau und Baumschule in Sarstedt wurde beobachtet, dass Eicheln im Freiland tiefere Temperaturen tolerieren als solche im Kühllager. Derzeit wird erforscht, wie diese Erkenntnisse in ein praxisreifes Lagerverfahren mit deutlich längeren Lagerzeiten überführt werden könnte (Spethmann 2023, Guthke und Spethmann 1992).
Nach der Auffassung verschiedener Autoren weisen die Eicheln der Roteiche nach der Ernte eine Keimhemmung auf (Korstian 1927, Vilmorin 2025, Suszka et al. 1994), welche sich aber durch eine relativ kurze Lagerung in kühler, feuchter Umgebung brechen ließe. Zur Brechung der Keimhemmung sollten die Eicheln 4 – 13 Wochen lang bei 0 – 5 °C gelagert werden (Korstian 1927, Vilmorin 2025, Suszka et al. 1994, Olson 1974, Gordon und Rowe 1982). In den ISTA-Regeln ist für die Saatgutprüfung bei den Arten der Gattung Quercus, also auch für Q. rubra L., dennoch keine Stratifizierung vor Beginn des Keimtests vorgesehen (ISTA 2020). Werden angekeimte Eicheln entkeimt bzw. bricht der Keimling ab, können die Eicheln nochmal austreiben. Dies ist bei der Roteiche bis zu zwei Mal möglich, wobei allerdings die Sämlinge zunehmend kleiner werden (Schubert 1999).
Anzucht und Sortimente
Die Eicheln können in milden Klimaten noch im Herbst gesät werden. Insbesondere bei der Herbstsaat sollten die Eicheln gegen Vögel und Mäuse geschützt werden. Eine Einlagerung bis zum Frühjahr ist dort sinnvoll, wo mit Spätfrostschäden an den Samen bzw. Sämlingen gerechnet werden muss (Suszka et al. 1994, Burkart 2018). Mac Cárthaigh et al. (2023) nennt als mögliche Aussaatzeitpunkte die Monate November – Dezember bzw. April – Mai, vergleichbar mit den heimischen Stiel- und Traubeneichen. Unabhängig vom Saatzeitpunkt erfolgt die Keimung selbst aber erst im Frühjahr (April bis Mai).
Nach der Saat im Saatbeet werden die Eicheln mit einer dünnen Streuschicht als Verdunstungsschutz überdeckt (Sander 1990). Auchmoody et al. (1994) fanden bei einer Untersuchung während eines guten Mastjahres heraus, dass vergrabene Eicheln gegenüber auf dem Boden aufliegenden Eicheln signifikant weniger von Insekten befallen oder von Kleinsäugern (v. a. Streifenhörnchen und Mäuse) weggetragen werden.
Bei der Aussaat bzw. natürlichen Ansamung im Wald ist eine ausreichende Belichtung der Sämlinge der wichtigste Überlebensfaktor in den ersten Jahren (McGee 1968, Sander 1979). Einmal etabliert, sind Roteichen-Sämlinge jedoch sehr robust gegenüber Schädigungen des oberirdischen Sprosses bzw. die Wurzel überlebt auch eine wiederholte Schädigung oder gar Vernichtung der oberirdischen Pflanze z. B. durch Waldbrand und treibt anschließend erneut aus (Sander und Clark 1971).
Bei der Aussaat in der Baumschule müssen nach Mac Carthaigh et al. (2023) zwischen 50 und 70 Kilogramm Saatgut pro 100 m2 aufgewendet werden. In Polen wird eine Saatgutmenge von 50 kg 1.-Wahl-Saatgut pro 100 m2 für die Rillen-Saat bzw. 200 – 300 kg 1.-Wahl-Saatgut für die breitwürfige Aussaat verwendet. In Nordamerika werde allgemein dichter gesät, wobei in den betreffenden Gebieten auch deutlich höhere Niederschläge als in Polen fielen (Suszka et al. 1994). Für die Sämlingsausbeute werden Werte von 130 – 200 Sämlinge pro Kilogramm Saatgut (Burkart 2018) oder 240 – 300 Sämlinge/kg (Mac Cárthaigh et al. 2023) genannt.
Übliche Sortimente bei der Roteiche sind ein- und zweijährige, unverschulte Pflanzen (1/0 und 2/0) (Suszka et al. 1994, Burkart 2018). Es werden aber zur Überbrückung schlechter Mastjahre auch zwei- und dreijährige Pflanzen (2/0 und 3/0) produziert (Suszka et al. 1994). Nach Burkart (2018) erfolgt auch ein Wurzelschnitt durch Unterfahren. Eine mögliche Erkrankung im Saatbeet stellt der Mehltau dar (Burkart 2018).
Vegetative Vermehrung
Nach Zaczek et al. (2006) funktioniert die Stecklingsvermehrung bei Roteiche nur mit Trieben von einjährigen Sämlingen. Die Vermehrung über eine Veredlung ist mit verschiedenen Veredlungstechniken möglich (Spethmann 2023, Bärtels 1996) und für die Begründung von Samenplantagen geeignet, jedoch für die reguläre forstliche Verwendung der Pflanzen zu teuer. Auch eine In-Vitro-Vermehrung ist prinzipiell möglich (Vendagesan und Pijut 2009).
Roteichen haben ein gutes Stockausschlagvermögen (Sander 1971, 1972; Burkardt 2017). Wurzelbrut kommt aber nicht vor (Burkardt 2017). Die Stockausschläge wachsen schnell und bilden regelmäßig gerade, gut geformte Stämme. Am Stammfuß können aber mitunter starke Krümmungen auftreten (Johnson 1974, Sander 1990).
Genetik und Anpassungsfähigkeit
Bei der Einfuhr von nichtheimischen Arten kann es durch die Auswahl von nicht geeignetem Material zu genetischer Einengung kommen. Dabei enthalten die eingeführten Populationen oft nur einen Bruchteil der genetischen Informationen im Vergleich zu dem natürlichen Verbreitungsgebiet, aus dem sie stammen (Nei et al. 1975, Barrett und Husband 1990). Dieser Effekt wird genetisch als »Gründereffekt« bezeichnet. Dabei begründet das eingeführte Material eine neue Population und ist genetisch eingeengt, wenn das Saatgut nicht eine möglichst breite genetische Basis aufweist. Eine begrenzte Saatguternte führt zu einem genetischen Engpass, wodurch die neu gegründete Population nicht die gesamte Variationsbreite der Art repräsentiert (Pettenkofer et al. 2019). Die entstandenen Gründerpopulationen sind meist sehr klein und daher stärker von zufälliger Drift betroffen (Graw 2005).
Neuere Ergebnisse von genetischen Untersuchungen zeigen, dass deutsche Roteichenbestände im Vergleich zu Referenzpopulationen aus dem natürlichen Verbreitungsgebiet eine relativ geringe genetische Differenzierung zwischen den Populationen aufweisen (Pettenkofer et al. 2019). Die Ergebnisse wurden anhand von Chloroplastenuntersuchungen gewonnen und zeigen, dass die Diversität der untersuchten deutschen Populationen nur einen kleinen Teil der in Nordamerika gefundenen Haplotypendiversität repräsentieren (Pettenkofer et al. 2019). Allerdings wurde in Baden-Württemberg eine deutlich höhere Haplotypenvariabilität als in anderen deutschen Beständen festgestellt. Während die meisten deutschen Bestände Anzeichen von Gründereffekten zeigten, könnte die Vielfalt der Bestände in Süddeutschland durch Vermischung und mehrfache Einführung verschiedener nordamerikanischer Herkünfte erhöht worden sein. Insgesamt kommt die Studie von Pettenkofer et al. (2019) zu dem Schluss, dass die deutschen Bestände aus einem begrenzten geografischen Gebiet stammen, das möglicherweise im nördlichen Teil des ursprünglichen Verbreitungsgebiets in Kanada und den USA um die Großen Seen herum liegt.
Mittels einer weiteren Art von genetischen Markern (Kernmikrosatelliten) konnten zusätzliche Erkenntnisse gewonnen werden. Die genetischen Vielfaltsparameter der deutschen und nordamerikanischen Bestände waren ähnlich hoch (Pettenkofer et al. 2020). Bemerkenswert war der Unterschied in den privaten Allelen (Allele, die nur in der jeweiligen Population vorkommen), die in Nordamerika deutlich höher waren. Der Vergleich zwischen potenziell adaptiven und neutralen Mikrosatellitenmarkern ergab für die deutschen Bestände keine Anzeichen von Selektion. Daher gehen die Autoren davon aus, dass die eingeführten Populationen aus Herkünften entstanden sind, die an ähnliche Umweltbedingungen wie in Deutschland angepasst waren. Die Ergebnisse deuten bisher darauf hin, dass die offensichtliche Einführung aus einem begrenzten geografischen Verbreitungsgebiet in Nordamerika mit einem geringeren Anpassungspotenzial auf zukünftig sich ändernde Umweltbedingungen einhergehen könnte (Pettenkofer et al. 2020).
Die Roteiche zählt zur Sektion Lobatae (Roteichen), deren natürliche Verbreitung auf Nordamerika beschränkt ist. Innerhalb der Sektion Lobatae ist eine Kreuzung mit anderen Arten möglich, wobei bis zu zwölf Hybride im ursprünglichen Verbreitungsgebiet gefunden wurden. Mit unseren einheimischen Weißeichenarten der Sektion Quercus hybridisiert die Roteiche nicht (Magni Diaz 2004, Nagel 2015, Burkardt 2017).
Genom
Die Roteiche ist diploid mit einem einfachen Chromosomensatz von n = 12 (NCBI 2025). Die Genomgröße der Roteiche liegt bei 739 Megabasen (Mb). Im Vergleich dazu haben die heimischen Eichenarten ein et was größeres Genom mit 824 Mb bei Q. petraea und 790 Mb Q. robur (NCBI 2025).
Genetische Diversität in bayerischen Erntebeständen
 Zoombild vorhanden
Zoombild vorhanden
Abb. 5: Genetische Vielfaltsparameter der fünf bayerischen Roteichenbestände. (Na, Mittlere Anzahl der Allele; Ne, Mittlere effektive Anzahl der Allele; He, erwartete Heterozygotie; Np, Mittlere Anzahl privater Allele)
Insgesamt wurden 15 Marker aus dem Zellkern für die Analysen an Q. rubra verwendet: quru-GA-1F07, quru-GA-1F02 (Aldrich et al. 2002), WAG065 (Durand et al. 2010), REO_371, REO_368, REO_433 (Konar et al. 2017), Qr6783 (Müller & Gailing 2018), QpZAG15 (Steinkellner et al. 1997), FIR053, PIE099, PIE039, PIE040, FIR104, GOT009, PIE125 (Sullivan et al. 2013).
Für die Chloroplasten wurden fünf Marker verwendet: μcd4, μdt1, μdt4 (Deguilloux et al. 2003), ccmp2, ccmp4 (Weising & Gardner 1999).
Die statistische Auswertung erfolgte mit den Softwareprogrammen Genalex (Peakall & Smouse 2012) und STRUCTURE, Version 2.3.4 (FALUSH et al. 2003), mit dem eine Clusteranalyse basierend auf einem Bayes’schen Ansatz durchgeführt wurde.
 Zoombild vorhanden
Zoombild vorhanden
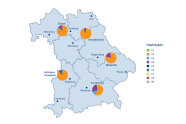
Abbildung 6: Verteilung der Haplotypen über fünf Bestände der Roteiche in Bayern.
Pettenkofer et al. (2019) fanden für Bestände in Baden-Württemberg eine höhere Vielfalt in den Chloroplastenmarkern, als für den Rest von Deutschland. Die Ergebnisse für Bayern zeigen ein ähnliches Bild und sind vermutlich ebenso aus mehreren Einfuhrereignissen entstanden. Insgesamt stellt aber die genetische Vielfalt der bayerischen Bestände nur einen Bruchteil der Vielfalt aus dem ursprünglichen Verbreitungsgebiet der Baumart in Nordamerika dar.
Genetische Unterschiede zwischen Beständen
Die genetischen Unterschiede zwischen den Beständen anhand der Kern-Marker sind gering (Abbildung 7 und 8). Der Abstand nach Nei (1972) liegt zwischen 0,014 (Jettingen-Scheppach und Schnabelwaid) und 0,042 Jettingen-Scheppach und Forstinning. Die genetische Ausstattung der fünf Bestände ist damit recht ähnlich.
| Mitterfels | Jettingen-Scheppach | Forstinning | Schnabelwaid | |
| 0,034 | Jettingen-Scheppach | |||
| 0,026 | 0,042 | Forstinning | ||
| 0,029 | 0,014 | 0,030 | Schnabelwaid | |
| 0,024 | 0,025 | 0,031 | 0,020 | Ebrach |

Abb. 8: Genetische Unterschiede zwischen den fünf Beständen der Roteiche in Bayern. Jede vertikale Linie stellt einen Baum dar. Die Zahlen entsprechen den untersuchten Beständen (1 = Mitterfels, 2 = Jettingen-Scheppach, 3 = Forstinning, 4 = Schnabelwaid, 5 = Ebrach).
An den Chloroplasten-Markern liegt der genetische Abstand nach Nei (1972) zwischen 0,001 (Jettingen-Scheppach und Ebrach) und 0,036 (Forstinning und Schnabelwaid) und ist damit noch niedriger als bei den Kern-Markern.
Die Clusteranalyse zeigte keine eindeutige Gruppierung an. Die beiden Genpools in den Farben blau und orange sind über alle fünf Populationen gleich verteilt (Abbildung 8). Das bedeutet, dass die genetischen Unterschiede zwischen den Beständen gering und deren Genpools sehr ähnlich sind. Vermutlich sind die bayerischen Bestände aus gemischtem Material mehrerer Ursprungsbestände oder aus bereits in Europa etablierten Beständen entstanden. In weiteren Untersuchungen mit einer größeren Anzahl von Saatguterntebeständen aus Deutschland und Österreich soll eine genauere Zuordnung der Bestände zu den Ausgangsbeständen im natürlichen Verbreitungsgebiet vorgenommen werden. Anschließend kann bewertet werden aus welchen Ursprungsbeständen die bayerischen Bestände abstammen und ob Saatgutimporte von trockenen Standorten aus dem Norden des ursprünglichen Verbreitungsgebiets in Bayern in Betracht gezogen werden. Aus genetischer Sicht können alle untersuchten Bestände in Bayern weiterhin als Saatguterntebestände genutzt werden. Um den vorhandenen Genpool zu erweitern, sollten Saatguterntebestände auch aus anderen europäischen Ländern z. B. aus Frankreich empfohlen und verwendet werden.
Erhaltung und Nutzung
Zugelassene Erntebestände
 Zoombild vorhanden
Zoombild vorhanden
Abbildung 9: Möglicher Plusbaum einer Roteiche im zugelassenen Erntebestand Forstinning in Bayern. Foto: M. Šeho
Gemäß der Herkunftsgebietsverordnung zum Forstvermehrungsgutgesetz (FoVG) werden für Vermehrungsgut von Q. rubra in Deutschland zwei Herkunftsgebiete unterschieden: 01 – Norddeutsches Tiefland und 02 – Übriges Bundesgebiet.
In guten Mastjahren, wie 2008, steht bundesweit eine Saatgutmenge von ca. 120 t zur Verfügung (Bachmann et al. 2009). Im Zeitraum 2014 – 2018 wurden bundesweit fünf Ernten durchgeführt und 231.582 kg Saatgut aus ausgewählten Saatguterntebeständen gewonnen. Im Vergleich dazu wurden im Zeitraum von 2019 – 2023 ebenfalls in fünf Ernten 311.293 kg Saatgut gewonnen (BLAG 2024).
Der Vergleich genetischer und phänologischer Merkmale von Roteichenbeständen in Frankreich lässt erste Anpassungen hinsichtlich bestimmter in Europa anders wirkender Selektionsfaktoren (z. B. Spät- und Frühfröste) vermuten (Daubree und Kremer 1993). Im östlichen Frankreich sind qualitativ sehr gute Erntebestände von Q. rubra mit hoher genetischer Variabilität vorhanden (Bachmann et al. 2009). Die Erntebestände der französischen Herkunftsgebiete 901 und 902 werden als klimaplastische Herkünfte in Bayern empfohlen. Des Weiteren wird empfohlen, Vermehrungsgut aus zugelassenen Saatguterntebeständen aus Österreich und Bulgarien im Rahmen von Praxisanbauversuchen auszuprobieren. Durch die erweiterten Herkunfts- und Verwendungsempfehlungen wird die Versorgung mit hochwertigem Vermehrungsgut gesichert (Abbildung 10).
Die Erhaltung forstlicher Genressourcen für Q. rubra erfolgt in Deutschland in 159 besonders wertvollen In-situ-Beständen auf einer Fläche von 310 ha. Das wertvolle Vermehrungsgut aus diesen Beständen sollte für die Saatgutgewinnung genutzt werden. Des Weiteren werden 52 In-situ-Einzelbäume sowie fünf Ex-situ-Bestände auf einer Fläche von 9,7 ha für die Erhaltung verwendet (BLAG 2024).
Literatur
- Aldrich, P.; Michler, C.; Sun, W. et al. (2002): Microsatellite markers for northern red oak (Fagaceae: Quercus rubra). Mol Ecol Notes 2: 472-474
- Amann, G. (1954): Bäume und Sträucher des Waldes. 19. Auflage
- www.artensteckbriefe.de: https://www.artensteckbrief.de/?ID_ Art=2996&BL=20012 (Zugriff am: 01.04.2025)
- Asche, N.; Dame, G.; Gertz, M.; Hein, F.; Kreienmeier, U.; Leder, B.; Naendrup, G.; Sonderrmann, P.; Spelsberg, G.; Stemmer, M.; Wagner, H.; Freiherr Wrede, E.V. (2007): Empfehlungen für die Wiederbewaldung der Orkanflächen in Nordrhein-Westfalen. Landesbetrieb Wald und Holz Nordrhein-Westfalen
- Auchmoody, L.R.; Clay Smith, H.; Walters, R.S. (1993): Acorn Production in Northern Red Oak Stands in Northwestern Pennsylvania. USDA Forest Service, Research Paper (NE-680)
- Auchmoody, L.R.; Clay Smith, H.; Walters, R.S. (1994): Planting Northern Red Oak Acorns: Is Size and Planting Depth Important? USDA Forest Service. Research Paper NE-693
- Bachmann, M.; Konnert, M.; Schmiedinger, A. (2009): Vielfalt schaffen, Risiko verringern – Gastbaumarten als Alternative zur Fichte. LWF Wissen 63: 22-30
- Barrett, S.C.; Husband B.C. (1990): The genetics of plant migration and colonization. In: Brown HD, Clegg MT, Kahler AL et al. (eds) Plant population genetics, breeding, and genetic resources. Sinauer Associates Inc., Massachusetts, pp 254-277
- Bärtels, A. (1996): Gehölzvermehrung. 4. Aufl., E. UlmerVerlag, Stuttgart.
- Bauer, F. (1953a): Die Roteiche. J.D. Sauerländer’s Verlag, Frankfurt a. M.
- Bayerisches Staatsministerium für Ernährung, Landwirtschaft und Forsten (2020): Baumarten für den Klimawald
- BLAG (2024): Tätigkeitsbericht der Bund-Länder-Arbeitsgruppe Forstliche Genressourcen und Forstsaatgutrecht
- Bonvicini, M.-P. (1993): Presentation of the Tree Seed Center »La Joux« (France) – Results about storage of acorns on a large scale – Chemical potection during storage: interests and limits. Internationales Symposium über Forstsaatgut 8.-11. Juni 1993. Proceedings, Münster/Uelzen, 193-209
- Brun, C. (1987): Zur Bestandeserziehung und Stammqualität bei Roteichen-Jungbeständen im Fricktal/Aargau. Allg. Forstzeitschr. 42: 51-52
- Burkardt, K. (2017): Kurzportrait Roteiche (Quercus rubra L.) – http://www.waldwissen.net
- Burkart, A. (2018): Kulturanleitungen für Waldbäume und Wildsträucher. Anleitungen zur Samenernte, Klengung, Samenlagerung und Samenausbeute sowie zur Anzucht von Baum- und Straucharten. WSL Berichte 63: 104 S.
- Cooper, C.; Struve, D.K.; Bennett, M.A. (1991): Pericarp splitting after aerated water soak can be used as an indicator of red oak seed quality. Canadian Journal of Forest Research, 21. (1991) 11: 1694-1697
- Darley-Hill, S.; Carter Johnson, W. (1981): Acorn dispersal by the blue jay (Cyanocitta cristata). Oecologia 50: 231-232
- Daubree, J.B.; Kremer, A. (1993) Genetic and phenological differentiation between introduced and natural populations of Quercus rubra L. Ann For Sci 50: 271-280
- Deguilloux, M.F.; Dumolin‐Lapègue, S.; Gielly, L.; Grivet, D.; Petit, R.J. (2003): A set of primers for the amplification of chloroplast microsatellites in Quercus. Molecular Ecology Notes, 3(1): 24-27
- Delatour, C.; Morelet, M. (1979): La pourriture noire de glands. Revue Forestiere Francaise, issue 2, 31, pages 101-115. DOI: 10.4267/2042/21268
- Desmarais, K.M. (1998): Northern Red Oak Regeneration: Biology and Silviculture. University of New Hampshire, Department of Natural Resources, Durham.
- Dlugosch, K.M.; Parker, I.M. (2008): Founding events in species invasions: genetic variation, adaptive evolution, and the role of multiple introductions. Molecular ecology, 17(1): 431-449
- Doyle, J.J.; Doyle, J.L. (1987): A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical bulletin.
- Dreßel, R.; Jäger, E.J. (2002): Beiträge zur Biologie der Gefäßpflanzen des herzynischen Raumes. 5. Quercus rubra L. (Roteiche): Lebensgeschichte und agriophytische Ausbreitung im Nationalpark Sächsische Schweiz. Hercynia 35: 37-64
- Durand, J.; Bodénès, C.; Chancerel, E.; Frigerio, J.M.; Vendramin, G.; Sebastiani, F.; ... & Plomion, C. (2010): A fast and cost-effective approach to develop and map EST-SSR markers: oak as a case study. BMC genomics, 11: 1-13
- Eisenhauer, D.R.; Roch, T.; Irrgang, S.; Sonnemann, S.; Gemballa, R. (2005): Bestandeszieltypen. Richtlinien für den Staatswald des Freistaates Sachsen. Landesforstpräsidium Sachsen, Pirna/ OT Graupa.
- Erntezulassungsregister (EZR): Internetzugriff am 5.2.2025
- Falush, D.; Stephens, M.; Pritchard, J.K. (2003): Inference of population structure using multilocus genotype data: linked loci and correlated allele frequencies. Genetics 164: 1567-1587
- Gockede, J. (2010): Wuchsleistungen verschiedener Roteichen-Herkünfte in Nordwest-Deutschland. Unveroff. Masterarbeit an der Fakultät für Forstwissenschaften und Waldökologie der Universität Göttingen. 72 S.
- Göhre, K.; Wagenknecht, E. (1955): Die Roteiche und ihr Holz. Deutscher Bauernverlag, Berlin.
- Gordon, A.G.; Rowe, D.C.F. (1982): Seed manual for ornamental trees and shrubs. Forestry Commission, Bulletin 59, London. Her majesty’s stationary office, 1982, 132 p.
- Graw, J. (2005): Genetik, 4th edn. Springer, Berlin Gribko, L.S.; Schuler, T.M.; Ford, W.M. (2002): Biotic and Abiotic Mechanisms in the Establishment of Northern Red Oak Seedlings: A Review. USDA Forest Service, General Technical Report (295)
- Gribko, L.S.; Schuler, T.M.; Ford, W.M. (2002): Biotic and Abiotic Mechanisms in the Establishment of Northern Red Oak Seedlings: A Review. USDA Forest Service, General Technical Report (295)
- Guthke, J.; Spethmann, W. (1993): Physiological and pathological aspects of longterm-storage of acorns. Annales Sciences Forestieres 50: 384-387
- Hickel, R. (1932): Dendrologie forestière. Lechevalier, Paris
- Holthausen, R. (1987): Die Bornheimer Roteiche. Allgemeine Forstzeitschrift 42, 44 Houba, J. (1887): Les chênes de l’amérique septentrionale en Belgique. leur origine, leur qualités, leur avenir. In: Ceysens M. (ed) Hasselt
- Houba, J. (1887): Les chênes de l’amérique septentrionale en Belgique. leur origine, leur qualités, leur avenir. In: Ceysens M. (ed) Hasselt
- ISTA (International Seed Testing Association) (2020): International Rules for Seed Testing 2020. Introduction to the ISTA Rules Chapters 1-19, https://doi.org/10.15257/istarules.2020.F
- Jenner, R. (2025): Saatgutprüfung bei der Roteiche. Mündliche Mitteilung 21.03.2025
- Jensen, T. S.; Nielson, O. F. (1986): Rodents as seed dispersers in a heath-oak wood succession. Oecologia 70: 214-221
- Konar, A.; Choudhury, O.; Bullis, R.; Fiedler, L.; Kruser, J.M.; Stephens, M.T.; ... & Romero-Severson, J. (2017): High-quality genetic mapping with ddRADseq in the non-model tree Quercus rubra. BMC genomics, 18: 1-12
- Kormann, J.M.; van der Maaten-Theunissen, M.; Unterholzner, L.; Liesebach, M.; Liepe, K.J.; van der Maaten, E. (2024): Variation in vessel traits of northern red oak (Quercus rubra L.) provenances revealed high phenotypic plasticity to prevailing environmental conditions. Trees 38(5):1283-1295, DOI:10.1007/ s00468-024-02557-y
- Korstian, C.F. (1927): Factors controlling germination and early survival in oaks. Bull. No. 19. New Haven, CT: Yale University, School of Forestry. 115 p.
- Korstian, C.F. (1927): Factors controlling germination and early survival in oaks. Yale School of Forestry Bulletin 19. 115 pp.+7 plates.
- Krahl-Urban, J. (1966): Vorlaufige Ergebnisse eines Roteichen-Provenienzversuchs. Allgemeine Forst- und Jagdzeitung 137: 91-100
- Liesebach, M.; Schneck, V. (2011): Entwicklung von amerikanischen und europäischen Herkünften der Roteiche in Deutschland. Forstarchiv 82, 4: 125-133
- Mac Cárthaigh, D.; Preil, W.; Spethmann, W. (2023): Methoden der Gehölzvermehrung. In: Krüssmann, G. (2023): Die Baumschule. Band 1
- Magni Diaz, C.R. (2004): Reconstitution de l’introduction de Quercus rubra L. en Europe et conséquences génétiques dans les populations allochtones. Dissertation, Ècole Nationale du Génie Rural, des Eaux et des Forêts (in French)
- McGee, C.E. (1968): Northern red oak seedlings growth varies by light intensity and seed source. USDA Forest Service, Research Note SE-90. Southeastern Forest Experiment Station, Asheville, NC. 4 p.
- Mitscherlich, G. (1957): Die Roteichenversuchsflächen der Badischen forstlichen Versuchsanstalt. Allg. Forst- u. Jagdztg. 128: 1-12
- Müller, M.; Gailing, O. (2018): Characterization of 20 new ESTSSR markers for northern red oak (Quercus rubra L.) and their transferability to Fagus sylvatica L. and six oak species of section Lobatae and Quercus. Ann. For. Res. 61(2): 211-222
- Nagel, R.-V. (2015): Roteiche (Quercus rubra L.). In: Vor, T.; Spellmann, H.; Bolte, A. et al. (eds) Potenziale und Risiken eingeführter Baumarten. Baumartenportraits mit naturschtuzfachlicher Bewertung. Univ.-Verl. Göttingen, Göttingen, pp 219-267
- NCBI: https://www.ncbi.nlm.nih.gov/datasets/genome/GCA_ 035136125.1/ (Internetzugriff am 5.2.2025)
- Nei, M. (1972): Genetic distance between populations. Am Nat 106(949): 283-292. https://doi.org/10.1086/282771
- Nesom, G. (2000): Northern Red Oak. Quercus rubra L. USDA Natural Resources Conservation Service, Plant Guide, Washington D.C.
- Nielsen, P.C. (1956): Beobachtungen an amerikanischen und europäischen Roteichenbeständen. Allgemeine Forstzeitschrift 11: 596-598
- Olson, D.F. Jr. (1974): Quercus L. Oak. In: Schopmeyer, C.S. (Ed.): Sees of Woody Plants in the United States. USDA Forest Service, Agriculture Handbook 450: 692-703. Washington DC.
- Peakall, R.; Smouse, P.E. (2012a): GenAlEx 6.5: genetic analysis in Excel. Population genetic software for teaching and research-an update. Bioinformatics 28: 2537–2539. https://doi. org/10.1111/j.1471-8286.2005.01155.x
- Pettenkofer, T.; Burkardt, K.; Ammer, C.; Vor, T.; Finkeldey, R.; Müller, M.; ... & Gailing, O. (2019): Genetic diversity and differentiation of introduced red oak (Quercus rubra) in Germany in comparison with reference native North American populations. European Journal of Forest Research, 138: 275-285
- Pettenkofer, T.; Finkeldey, R.; Müller, M.; Krutovsky, K.V.; Vornam, B.; Leinemann, L.; Gailing, O. (2020): Genetic variation of introduced red oak (Quercus rubra) stands in Germany compared to North American populations. European Journal of Forest Research, 139: 321-331
- Roloff, A. (2013): Bäume in der Stadt. E. Ulmer Verlag, Stuttgart.
- rubraSelect: https://www.rubraselect.de/startseite (Internetzugriff am 10.4.2025)
- Sander, I.L. (1965): Northern red oak Quercus rubra L.). In: Silvics of forest trees of the United States. p. 588-592. H.A. Fowells, comp. U.S. Department of Agriculture, Agriculture Handbook 271. Washington, DC.
- Sander, I.L. (1990): Quercus rubra L., northern red oak. In: Burns, R.M.; Honkala, B.H. (Eds.): Silvics of North America. Vol. 2, Quercus nigra to Tilia. USDA Forest Service, Agriculture Handbook 654: 727-733 Sander, I.L.; Clark, F.B. (1971): Reproducktion of upland hardwood forests in the Central States. U.S. Departement of Agriculture, Agriculture Handbook 405. Washington, DC. 25 p.
- Sander, I.L.; Clark, F.B. (1971): Reproducktion of upland hardwood forests in the Central States. U.S. Departement of Agriculture, Agriculture Handbook 405. Washington, DC. 25 p
- Sander, I.L: (1979): Regenerating oaks with the shelterwood system. In Proceedings, Regenerating Oaks in Upland Hardwood Forests. John S. Wright Forestry Conference. p. 54-60. Purdue University, West Lafayette, IN. Sander, I.L. (1971): Height growth of new oak sprouts depends on size of advance reproduction. Journal of Forestry 69(5): 194-297
- Sander, I.L. (1971): Height growth of new oak sprouts depends on size of advance reproduction. Journal of Forestry 69(5): 194-297
- Sander, I.L. (1972): Size of oak advance reproduction: key to growth following harvest cutting. USDA Forest Service, Research Paper NC-79. North Central Forest Experiment Station, St. Paul, MN. 6 p.
- Schirmer, R.; Tubes, M. (2024): Versuchsanbauten mit Roteiche – Grundlage zukünftiger Samenplantagen. In: Forum Forstgenetik–60 Jahre Herkunftssicherung und Forschung für die Praxis am Bayerischen Amt für Waldgenetik, Forstliche Forschungsberichte München 225: 102-117
- Schenck, C.A. (1939): Fremdländische Wald- und Parkbäume. 3. Band, 545-549. Verlag Paul Parey, Berlin. Schopmeyer, C.S. (technical coordinator) (1974): Seeds of woody plants in the United States. U.S. Department of Agriculture, Agriculture Handbook 450. Washington, DC. 883 p.
- Schopmeyer, C.S. (technical coordinator) (1974): Seeds of woody plants in the United States. U.S. Department of Agriculture, Agriculture Handbook 450. Washington, DC. 883 p.
- Schubert, J. (1998): Lagerung und Vorbehandlung von Saatgut wichtiger Baum- und Straucharten. Landesanstalt für Ökologie, Bodenordnung und Forsten / Landesamt für Agrarordnung Nordrhein-Westfalen (LÖBF). auch verfügbar unter: https://www.wald-und-holz.nrw.de/fileadmin/Publikationen/ Schriftenreihe/Schriftenreihe_Lagerung_Vorbehandlung_ Saatgut.pdf (Stand 20.03.2025)
- Schulenburg, K. (1966): Untersuchungen über Wasserreiserbildung an der Roteiche (Quercus borealis MICHAUX). Arch. Forstwes. Landsch.ökol. 15: 1073-1091
- Šeho, M.; Janßen, A. (2019): Alternativbaumarten im Klimawandel–Herkunftsversuche und Praxisanbauten sind unverzichtbar im Waldumbau. LWF aktuell, 4, 2019
- Sork, V.L. (1984): Examination of seed dispersal and survival in red oak, Quercus rubra (Fagaceae), using metal-tagged acorns. Ecology 65: 1020-1022
- Spethmann, W. (2023): Quercus – Eiche – Fagaceae. In: Krüssmann, G. (2023): Die Baumschule. Band 2
- Steinkellner, H.; Fluch, S.; Turetschek, E.; Lexer, C.; Streiff, R.; Kremer, A., ... & Glössl, J. (1997): Identification and characterization of (GA/CT) n-microsatellite loci from Quercus petraea. Plant Molecular Biology, 33: 1093-1096
- Sullivan, A.R.; Lind, J.F.; Mccleary, T.S. et al. (2013): Development and characterization of genomic and gene-based microsatellite markers in North American red oak species. Plant Mol Biol Rep 31: 231-239
- Suszka, B.; Muller, C.; Bonnet-Masimbert, M. (1994): seeds of forest broadleaves. from harvest to sowing. übersetzt ins Englische von Andrew Gordon (1996)
- Thompson, R.S.; Anderson, K.H.; Bartlein, P.J. (1999): Atlas of Relations between Climatic Parameters and Distribution of Important Trees and Shrubs in North America. U. S. Geological Survey Professional Paper 1650 A&B, Online-Version. http:// pubs.usgs.gov/pp/p1650-a/ (abgerufen am 01.09.2014)
- Tirmenstein, D.A. (1991): Quercus rubra. In: Fire Effects Information System USDA Forest Service, Rocky Mountain Research Station. https://www.fs.usda.gov/database/feis/plants/ tree/querub/all.html (Zugriff am 10.4.2025)
- Vengadesan, G.; Pijut, P. (2009): Somatic embryogenesis and plant regeneration of northern red oak (Quercus rubra L.). Plant Cell Tissue Organ Cult. 97: 141-149
- Vilmorin (2025): https://www.vilmorin-baumsamen.com/saatgut/zierbaumschule/1238-Quercus-rubra.html (Zugriff am 21.03.2025)
- Weising, K.; Gardner, R.C. (1999): A set of conserved PCR primers for the analysis of simple sequence repeat polymorphisms in chloroplast genomes of dicotyledonous angiosperms. Genome, 42(1): 9-19
- Zaczek, J.J.; Steiner, K.C.; Heuser, C.W.; Tzilkowski, W.M. (2006): Effects of serial grafting, ontogeny and genotype on rooting of Quercus rubra cuttings. Can. J. For. Res. 36: 123-131
Beitrag zum Ausdrucken
Weitere Informationen
Autoren
- Barbara Fussi
- Jonas Eckel
- Muhidin Šeho



