LWF Wissen 89
Roteiche: eine attraktive Alternative im Klimawandel?
von Melina Schaller, Wolfgang Falk, Andreas Hahn, Tobias Mette
Verbreitung in Nordamerika
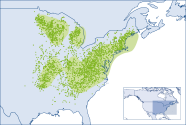
Das natürliche Verbreitungsgebiet der Roteiche (Quercus rubra L.) deckt fast die gesamte Osthälfte der USA ab (Abbildung 1). Im Westen wird sie durch die Graslandschaften der Great Plains begrenzt. Im Norden kommt sie bis ins südliche Kanada vor und ist damit die Eichenart mit der nördlichsten Ausdehnung Nordamerikas (Sander 1990). Südlich reicht sie hinab bis nach Alabama, Georgia und North Carolina (Little 1971), was eine beindruckende Nord-Süd-Ausdehnung von über 1.400 km ergibt (Vergleich: Luftlinie Kiel –Rom 1.390 km). Die Roteiche deckt auch einen großen Höhengradienten ab: von Meeresspiegelhöhe im nördlichen Teil ihres Verbreitungsgebietes dringt sie in den deutlich wärmeren Südappalachen bis in die montanen Höhenlagen von 1.070m (West Virginia) bzw. 1.680 m (südliche Appalachen) vor (Sander 1990).
Klimatisch entspricht das natürliche Verbreitungsgebiet der Roteiche in der nördlichen Hälfte nach Köppen-Geiger einem sommerwarmen bis sommerheißen, winterfeuchten Kontinentalklima (Dfb, Dfa) und in der südlichen Hälfte einem subtropischen, sommerheißen aber winterfeuchten Ostseitenklima (Cfa) (Peel et al. 2007). Bayern, welches ebenfalls als sommerwarmes, winterfeuchtes Kontinentalklima (Dfb) klassifiziert ist, entspricht klimatisch also am ehesten den Bedingungen im nördlichen Teil des natürlichen Verbreitungsgebietes, weist aber mit Ausnahme der Alpen deutlich geringere Jahres- und Vegetationszeitniederschläge auf (Peel et al. 2007).
Entsprechend ihrer großen geographischen Ausdehnung ist die Spannbreite der klimatischen Bedingungen, unter denen die Roteiche vorkommt, beachtlich. Die Jahresmitteltemperatur variiert zwischen 4 °C im Norden und 16 °C im Süden. Während im nördlichen Teil des Verbreitungsgebietes in den kalten Wintern (Januarmitteltemperatur bis –11 °C) reichlich Schnee fallen kann (Jahresmittel 254 cm), zeichnet sich der südliche Teil des Verbreitungsgebietes durch deutlich mildere Winter mit wenig bis keinem Schnee und Januarmitteltemperaturen bis zu 5 °C aus (Sander 1990). Aufgrund der zunehmenden Meeresferne, der Wirkung des Regenschattens der Rocky Mountains und der vorherrschenden Windrichtungen nehmen die Niederschläge im Verbreitungsgebiet der Roteiche von Osten nach Westen ab (Columbia Climate School 11.04.2018; Sander 1990). Die Jahresniederschläge sind reichlich und variieren zwischen 760 mm im Nordwesten und 2.030 mm in den Südappalachen, die Sommerniederschläge zwischen Juni und August zwischen 260 mm und 408 mm (Sander 1990).
 Zoombild vorhanden
Zoombild vorhanden
Abb. 1: Die Verbreitung der Roteiche in Nordamerika, basierend auf Waldinventurdaten (Forest Service, 2023; National Forest Inventory, 2023). Die Grüne Fläche stellt den Anbauschwerpunkt dar und umfasst 80 % der Nachweise mittels Kerndichteschätzung »kernel density«. Grafik: M. Schaller
Anbau in Europa
 Zoombild vorhanden
Zoombild vorhanden
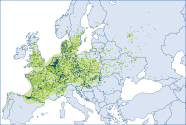
Abb. 2: Anbaunachweise der Roteiche in Europa in den ForestEU-Waldinventuren, blau (Mauri et al. 2017) und grün (Daten der global biodiversity information facility GBIF, Abruf 03/2025). Die Grüne Fläche stellt den Anbauschwerpunkt dar und umfasst 80 % der Nachweise mittels Kerndichteschätzung »kernel density«. Grafik: T. Mette
Heute reicht der Anbauschwerpunkt der Roteiche in Europa vom spanischen Baskenland bis nach Südschweden und von Südengland bis zur ukrainisch-rumänischen Grenze (Abbildung 2). Auf Grundlage von Nicolescu et al. (2020) schätzen wir die Anbaufläche vorsichtig auf 160.000 bis 180.000 Hektar, wobei nicht immer klar ist, ob Anteile der Roteiche und Anteile von Beständen mit (führender) Roteiche unterschieden werden. In Deutschland ist die Roteiche die häufigste nicht-heimische Laubbaumart mit 44.000 ha (BWI 2012). In Frankreich ist sie nach der Robinie der zweithäufigste nicht-heimische Laubbaum mit 61.000 ha (IGN 2025). In den Niederlanden rangiert die Roteiche nach Stieleiche und Waldkiefer sogar insgesamt auf dem dritten Rang, noch vor Douglasie und Rotbuche (Mauri et al. 2017), mit einer Anbaufläche von knapp 9.000 ha (Nicolescu et al. 2020). Wie die zahlreichen Roteichen-Nachweise aus der Biodiversitätsdatenbank GBIF in Abbildung 2 zeigen, kommt die Roteiche darüber hinaus sowohl bis ins mediterrane Portugal und Italien als auch bis ins kontinentale Russland hinein vor – in der Ukraine allein finden sich etwa 45.000 ha (Hayda et al. 2022).
Der Schwerpunkt des europäischen Roteichenanbaus liegt allerdings in einem Klima, das wesentlich ozeanischer (also wintermilder und sommerkühler) und niederschlagsärmer ist als das nordamerikanische Verbreitungsgebiet. Noch am ehesten deckt sich das europäische Anbauklima mit dem Verbreitungsgebiet der Varietät rubra der nördlichen Appalachen und Großen Seen. Diese Varietät ist den Roteichen Europas genetisch ähnlicher als die südliche (Merceron et al. 2017, Magni-Diaz 2004). Die insgesamt hohe genetische Variabilität in europäischen Beständen ist wahrscheinlich auf gemischtes Saatgut aus unterschiedlichen Herkunftsgebieten zurückzuführen (Daubree und Kremer 1993). Dies ist eine wichtige Vorbedingung für eine genetische Differenzierung unter den hiesigen Klimabedingungen und der Grund dafür, dass sich Krahl-Urban (1966) ebenso wie Liesebach und Schneck (2011) bei Anbauten in Europa für die Verwendung europäischen Saatguts aussprechen.
In Deutschland gilt die Roteiche als anbaufähig und anbauwürdig. Das erste Kriterium schließt unter anderem auch eine Invasivität der Art aus, das zweite hebt Vorteile des Anbaus gegenüber heimischen Alternativen hervor (Nagel 2015). So kann Roteiche in Kiefernbeständen zur Melioration der Böden (Nagel 2015) und zum Brandschutz (Kaulfuss 2011) beitragen. Ihre Wuchskraft und Schattentoleranz machen sie gut geeignet zur Mischung mit Rotbuche, Hainbuche und Winterlinde (Nagel 2015). In Mischung mit der Stiel und Traubeneiche hingegen ist die Roteiche sowohl auf besser wasser- und nährstoffversorgten Böden als auch auf klimatisch warmtrockenen Standorten überlegen und kann die heimischen Eichen zurückzudrängen (Nagel 2018, Klemmt et al. 2013, Dresel und Jager 2002).
Klimanische Roteiche
Als kontinental geprägte Art toleriert die Roteiche große Temperaturschwankungen im Jahresverlauf und kalte Winter. Obwohl sie starke Winterkälte ertragen kann (Januar-Mittel bis – 14 °C, Tages-Minima bis – 43 bis – 50 °C; Larcher 1981), wurde an ein- bis zweijährigen Pflanzen gezeigt, dass starke, späte Winterkälte das Wachstum im folgenden Jahr verringern kann, was die Konkurrenzkraft der Roteiche vermindern würde (Guiden et al. 2018). In Europa wird sie im Mittel an winterwärmeren Standorten als in Nordamerika angebaut und auch die Minimalwerte ihres Herkunftsgebietes werden nicht erreicht. Die Kältegrenze dürfte demzufolge bei den bisherigen europäischen Anbauten eine untergeordnete Rolle spielen. Dennoch können diese Kältelimitationen die nördliche Grenze und Höhengrenze der Roteiche definieren. Ferner können Spätfrostereignisse zu signifikanten Gewebeschädigungen und damit Wachstumseinbrüchen führen, sofern die Bäume bereits ausgetrieben haben (Kormann et al. 2024). Die Spätfrostanfälligkeit wird ähnlich hoch wie bei den einheimischen Eichen eingeschätzt. Zum einen kann man dieser Gefahr bei der Roteiche aber mit der Wahl einer angepassten Provenienz begegnen, zum anderen können geschädigte Roteichen dank ihres starken Wiederaustriebes Frostschäden schneller überstehen als die einheimischen Eichen (Nagel 2015, Kormann et al. 2024).
 Zoombild vorhanden
Zoombild vorhanden
Abbildung 3: Klimanische der Roteiche in ihrem Anbauschwerpunkt in Europa, basierend auf Waldinventurdaten (Mauri et al. 2017). Grafik: M. Schaller
Obwohl die Roteiche in Nordamerika als »auf relativ mesische (mittelfeuchte) Standorte beschränkte« Eichenart beschrieben wird, gilt sie in Europa eher als trockenheitstolerant (Abrams 1990, Nicolescu et al. 2020). Diese Einschätzung lässt sich durch die bisherigen Anbauerfahrungen in Europa erklären, die im Mittelwert bei 239 mm Sommerniederschlag, 394 mm Vegetationszeitniederschlag und 926 mm Jahresniederschlag liegen, wobei die trockensten Anbaustandorte nur 121 mm Sommerniederschlag erhalten (Abbildung 3). Im Gegensatz dazu sind die Roteichen in ihrem natürlichen Herkunftsgebiet besonders im wärmsten Quartal in der Regel gut wasserversorgt, mit mittleren monatlichen Niederschlägen von 265 bis 408 mm. Auch die mittleren Vegetationszeitniederschläge (546 mm) und Jahresniederschläge (1.145 mm) im Herkunftsgebiet liegen deutlich höher als in Westeuropa, mit Ausnahme von Gebirgs-Staulagen wie den Alpen. Dennoch gibt es Hinweise, dass die Roteiche die Trockenheitstoleranz der einheimischen Eichen übertreffen könnte. Ein- bis zwei-jährigen Pflanzen zeigen bei Dürre sowohl unter Gewächshaus- als auch unter Feldbedingungen geringere Wachstumseinbrüche als die einheimischen Eichen und regenerieren sich besonders auf armen Böden schneller (Rolando et al. 2025, Kupka und Vopalka- Melicharova 2020). In Kombination könnten diese Eigenschaften der Roteiche gegenüber den einheimischen Eichen auf marginalen, armen Waldstandorten eine größere Resilienz und Konkurrenzkraft verleihen, was sich durch die Verdrängung der Traubeneiche in den Riffwäldern (trockene, durch Kiefer, Birke und Eichen dominierte Wälder auf Sandsteinkuppen) der sächsischen Schweiz zu bestätigen scheint (Rolando et al. 2025, Dresel und Jager 2002). Dennoch wird auch die Roteiche durch Wassermangel limitiert. Wasserverfügbarkeit und insbesondere Sommerniederschläge korrelieren in mehreren Studien positiv mit dem Wachstum und scheinen das Wachstum auf niedrig gelegenen Standorten zu bestimmen, während es auf hoch gelegenen oder niederschlagsreichen Standorten von der Temperatur bestimmt wird (Stern et al. 2020, Kormann et al. 2024). Zudem liegt die Vermutung nahe, dass der negative Effekt hoher Temperaturen auf das Wachstum zumindest teilweise einem Wassermangel geschuldet ist: Sie führen zu hoher Verdunstung, was bei ungenügendem Wassernachschub durch Niederschläge in einer schlechten Wasserversorgung der Bäume resultiert (Kormann et al. 2024, Stern et al. 2020). Nagel (2015) und Dresel und Jager (2002) setzen, abgeleitet aus den Bedingungen aus dem natürlichen Herkunftsgebiet, das Niederschlagsminimum für Roteichenanbau bei mindestens 600 mm Jahresniederschlag und 300 mm Vegetationszeitniederschlag. Das legen auch Cech et al. (2023) nahe, die durch Wurzelfäule absterbende Roteichen im Osten Österreichs untersucht hatten. Die Anfälligkeit gegenüber dem ansonsten wenig pathogenen Pilz (Spindeliger Rübling) begründeten sie damit, dass die Roteiche durch die Kombination von durchschnittlich unter 500 mm Jahresniederschlag, steigenden Sommertemperaturen, Böden mit wenig Wasserspeicherkapazität durch Trockenstress sowie den Kalk in tieferen Bodenschichten geschwächt waren. Roteichen-Anbau unter 500 mm Jahresniederschlag sei demnach nur bei Jahrestemperaturen von unter 10 °C möglich.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 4: Ökogramm der Roteiche mit freundlicher Genehmigung von Dreßel und Jäger (2002).
Standortsansprüche und Standortsverhalten
Die Roteiche bildet ähnlich wie die heimischen Eichen in der Jugend eine Pfahlwurzel aus, die sich im Alter zu einem Herzwurzelsystem entwickelt (LWF 2020, Kupka und Vopalka-Melicharova 2020). Damit kommt sie auf verschiedenen Standorten zurecht, von schweren ton- und lehmreichen Böden bis hin zu ärmeren, sandigen oder kiesigen Böden, sofern diese nicht allzu trocken sind (Nesom 2001, Nicolescu et al. 2020). In Nordamerika kommt sie am häufigsten auf gut entwickelten, eher fruchtbaren Böden mit einem tonangereicherten Unterboden in humiden oder subhumiden Klima (»Udalfs«) und auf gut drainierten, neutralen bis leicht sauren, nährstoffreichen Böden mit tiefem AHorizont vor (»Udolls«) (Soil Conservation Service, U.S. Department of Agriculture 1977; Sander 1990). Bezüglich schwachem Stauwasser und tiefem Grundwasser ist die Roteiche tolerant, stagnierendes Wasser und Überflutungen toleriert sie nicht (Nagel 2015). Die Staunässetoleranz ist nach Niinemets und Valladares (2006) leicht geringer als die der Traubeneiche, und damit deutlich geringer als jene der Stieleiche. Die Roteiche eignet sich nicht für die Pflanzung in bewaldeten Feuchtgebieten oder Mooren (Keller et al. 2024, LWF 2020, Abbildung 5 Patchtabelle).
Die Nährstoffansprüche der Roteiche ähneln denen der heimischen Eichenarten (Chytry et al. 2018). Die Roteiche wächst sowohl auf basenreichen als auch auf sauren Standorten, wobei basenreiche Standorte bevorzugt werden (Demchik und Sharpe 2000, in: FVA 2021). Das beste Wachstum zeigt sie auf tiefgründigem, sandigem Lehm mit leicht saurem pH-Wert, sie wächst aber auch auf Lehm, Ton und sandigen bis kiesigen Böden (Nagel 2015). In Deutschland stockt die Roteiche laut Mellert et al. (2020) auf Böden mit Basentyp 2 bis 4, d. h. sie toleriert sehr basenarme Böden, wird aber nach ihrem Optimum als intermediär klassifiziert. Ergebnisse von Major et al. (2013) legen nahe, dass Roteichen-Naturverjüngung Standorte mit hohem Carbonatgehalt meidet. Außerdem wurde beschrieben, dass das Wachstum auf trocken-kalkigen Standorten mit steigendem Kalkgehalt sinkt (Timbal & Dewilder 1994; Pilar-Landeau 1984). Entsprechend wird das Anbaurisiko bei freiem Kalk im Oberboden im Bayerischen Standortinformationssystem BaSIS als erhöht bewertet (LWF 2020, Abbildung 5 Patchtabelle). Mit zunehmendem Alter vermuten Kupka und Vopalka-Melicharova (2020) eine steigende Kalktoleranz.
Die Roteiche zeichnet sich vor allem in der Jugend durch eine höhere Schattentoleranz als die Stiel- und Traubeneiche aus (Savill 2013) und wird in Deutschland zwischen der Traubeneiche und der Rotbuche eingeordnet (Vor und Lupke, Vor 2005, Vor und Lupke 2004). 15 – 30 % Lichteinstrahlung genügen für ein optimales Wachstum (Kuehne et al. 2014). Erwachsene Roteichen sind hingegen klar den Lichtbaumarten zuzuordnen und Lichtmangel kann zu einem Rücksterben der Kronen führen (Sofletea und Curtu 2007). Zudem zeigt die Roteiche starken Phototropismus (Wuchs hin zum Licht), was zu ungünstigen Wuchsformen führen kann (Nagel 2015).
Wie das Ökogramm aus Dresel und Jager (2002) (Abbildung 4) zeigt, besetzt die Roteiche in Mitteleuropa ein breites Standortsspektrum: von feucht bis trocken und von stark sauer bis neutral. Dass sie nur im sauren bis mäßig sauren und mäßig trockenen bis trockenen Bereich zur Vorherrschaft gelangen kann, liegt eher daran, dass im mittleren Standortsbereich bei geschlossenem Laubholzschirm die Rotbuche aufkommende Roteichen-Verjüngung ausdunkeln würde (Nagel 2015). In gleichaltrigen Beständen kann die Roteiche hingegen lange mit der Rotbuche mithalten (Nagel 2018). Das beste Wachstum zeigt die Roteiche im mittleren Standortsbereich auf tiefgründigem, sandigem Lehm mit leicht saurem pH-Wert (Nagel 2015). Auf gleichen Standorten ist die Wuchsleistung der Roteiche der Stiel- und Traubeneiche deutlich überlegen (Klemmt et al. 2013, Bauer 1953, Gohre und Wagenknecht 1955). Im sauren bis mäßig sauren und mäßig trockenen bis trockenen Bereich kann sie gegenüber der Buche und anderen heimischen Arten zur Dominanz kommen (Dresel und Jager 2002). Aufgrund ihrer Schattentoleranz und Wuchskraft ist sie beispielsweise auch auf extremen Standorten der sächsischen Schweiz der Kiefer, Birke und Traubeneiche überlegen und schattet diese Arten aus (Dresel und Jager 2002). Auch die Fallstudie von Kupka und Vopalka-Melicharova (2020) deutet die Überlegenheit von jungen Roteichen gegenüber Traubeneichen in den Trockenjahren 2018 und 2019 in Böhmen an.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 5: Risikobewertung der Roteiche im Bayerischen Standortinformationssystem BaSIS (LWF, 2020).
Der Einfluss der Roteiche auf den Boden wird kontrovers diskutiert (vgl. Nagel 2015). In einem Vergleich mit Traubeneiche zeigten Miltner et al. (2016) unter Roteiche auf sauren Braunerden in Tschechien niedrigere pH-Werte, höhere Azidität (Al3+), geringere Basengehalte und -sättigungen, niedrigere N-Gehalte und damit weitere C/N-Verhältnisse sowie geringere pflanzenverfügbare Nährelemente (P, K, Ca, Mg). Bezüglich der Streuabbaubarkeit gibt es unterschiedliche Aussagen (FVA 2021, Nagel 2015). Insgesamt zitiert Nagel (2015) eine differenzierte Bewertung der Bodenpfleglichkeit, die neben Streuzersetzung auch Durchwurzelung und Auswirkungen auf das Mikroklima, Bodenfeuchte und Effekte auf die Bodenvegetation berücksichtigt. Daher findet sich in älterer Literatur häufig eine positive Bewertung der Roteiche. Da insbesondere auf schwierigen Grenzstandorten die Baumart Roteiche zum Walderhalt beitragen kann, wäre dort auch die Bodenpfleglichkeit im Vergleich zu einem lichteren und weniger wüchsigen Bestand zu bewerten und daher trotz ggf. schwieriger Zersetzung insgesamt als positiv zu sehen. Die Streuauflagen der Roteiche können für einige andere Bauarten ein Keimhindernis darstellen. Majekova et al. (2024) berichten über die Absonderung von Hemmstoffen, die die Biomasse von krautigen Pflanzen reduzieren.
Waldschutz
Aus Sicht des Waldschutzes könnte man die Roteiche (Quercus rubra) als eine gelungene Wahl bezeichnen: In Mitteleuropa gibt es bisher weniger Schadorganismen an der Roteiche, die im Vergleich mit den einheimischen Eichenarten auch zu geringeren Schäden führen (Nagel 2015). Dieses Muster wiederholt sich interessanterweise auch im Vergleich mit den Roteichen in den nordamerikanischen Herkunftsgebieten (Dyderski et al. 2020). Nachfolgend wird sowohl ein kurzer Überblick über die in Mitteleuropa relevanten Schaderreger an Roteiche als auch ein Einblick in die angespanntere Waldschutzsituation in den Herkunftsgebieten gegeben.
An der Roteiche gibt es wenig phytophage Spezialisten und eine überschaubare Zahl von Generalisten, die ihr zu schaffen machen können. Zu den blattfressenden Schmetterlingsarten sei auf den Artikel von Muller-Kroehling/Schmidt im selben Heft und Sobczyk 2019 verwiesen.
Schwammspinner und Eichenprozessionsspinner nehmen die Roteiche nach Beobachtungen der Waldschutzdienststellen in Deutschland genauso an wie Stiel- und Traubeneichen. In Nordamerika führt der Fraß der Schwammspinnerraupen ebenfalls zu Kahlfraß; der Schwammspinner ist dort die entscheidende phytophage Art (Dyderski et al. 2020). Nicolescu et al. (2020) heben die höhere Regenerationsfähigkeit der Roteiche hervor, was nach Blattfraß an Roteichen in Sachsen bestätigt wurde. Frostspannerarten meiden die Roteiche eher. Insofern kann das Risiko für eine Bestandsgefährdung von Roteichenbeständen durch phyllophage Insekten deutlich geringer eingeschätzt werden als bei Stiel- und Traubeneiche.
Im nordamerikanischen Verbreitungsgebiet der Roteiche sind Schäden holzfressender Käfer deutlich relevanter als Schäden durch phytophage Arten. Von überregionaler Bedeutung ist dort der Roteichenbock Enaphalodes rufulus (Dyderski et al. 2020). Seine Larven entwickeln sich unter der Rinde im Phloem lebender Roteichen (analog z. B. rindenbrütenden Borkenkäfern oder Prachtkäfern bei uns), wodurch die Bäume geringelt werden und je nach Befallsdichte absterben. Die Befallsdichten scheinen in den letzten Jahrzehnten deutlich angestiegen zu sein, wodurch der Käfer zu einer „major pest“ wurde (Stephen et al. 2001, Dyderski et al. 2020). Bei uns ist E. rufulus bisher nicht etabliert.
Interessanterweise scheinen bei uns die Gefährdungen in der Kultur- und Jugendphase etwas höher zu sein als in der Altersphase. Engerlingsfraß kann lokal bedeutsam sein: Waldmaikäferengerlinge scheinen die Roteiche gegenüber den einheimischen Eichenarten sogar zu bevorzugen (Heydeck & Majunke 2002). Nach Beobachtungen trifft das auch auf den Reifungsfraß der Käfer zu. Die Roteiche gilt in der Jugend zudem als stark verbissgefährdet (Vor 2005, FVA 2021). Neben den einheimischen Arten gibt es auch Neozoen an der Roteiche: Der Roteichen-Zwergwickler Bucculatrix Ainsliella wurde in Mitteleuropa (Niederlande, Belgien) eingeschleppt (Nieukerken et al. 2012). Er ist seit 2011 in Nordrhein-Westfalen etabliert (Wittland 2014). Seine Raupen sitzen auf der Blattunterseite und verursachen einen Fensterfraß. Als weitere Art wurde die Roteichen-Blattlaus Myzocallis walshi in Bayern nachgewiesen (Sobczyk et al. 2024). Schäden sind durch beide bisher nicht bekannt.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 6: Fruchtkörper des Spindeligen Rüblings (Gymnospus fusipes). Foto: M. Blaschke
Wurzelfäulen sind hierzulande die aktuell augenscheinlichste Waldschutzthematik. Insbesondere der Spindelige Rübling (Gymnospus fusipes, Abbildung 6) sollte bei der Anpflanzung und Bewirtschaftung von Roteichen Beachtung finden. Er führt zu einer bestandsbedrohenden Wurzelfäule, die auf Böden mit geringer Wasserhaltekapazität und hohem Kalkgehalt nach Trockenstress auftreten kann. Interessanterweise wird man auf die Fäule im Wurzelraum erst Jahre nach der Infektion durch die oberirdischen Fruchtkörper aufmerksam. Cech et al. (2023) haben diese bei Beprobungen in Österreich erst bei Beständen > 50 Jahren festgestellt. Daher ist die Beachtung des Standorts bei der Anpflanzung existenziell. Um die Wahrscheinlichkeit einer Infektion mit dem Spindeligen Rübling möglichst zu vermeiden, raten sie Standorte mit geringer Wasserhaltekapazität (Sande oder Schotter) und hohem Kalkgehalt zu meiden. Einschränkungen für Böden mit geringer Wasserhaltekapazität und hohem Kalkgehalt formulierten zuvor auch Metzler et al. (2010) und Timbal & Dewilder (1994). Dies deckt sich mit den Einschätzungen zur Kalkverträglichkeit der Roteiche aus Standortssicht.
Neben dem Spindeligen Rübling wurde Biscogniauxia mediterranea als neues Pathogen an Roteiche beschrieben, das nach Trockenphasen auftritt – vergleichbar mit der Pfennigkohlenkruste B. nummularia bei Rotbuche und daher nur unter extremer Trockenheit von Relevanz. Und auch Hallimasch tritt immer wieder an Roteiche auf.
Aus Waldschutzsicht sollte man pilzliche Schaderreger (v. a. den Spindeligen Rübling) und xylobionte Käfer bei der Forstwirtschaft mit der Roteiche besonders im Auge behalten. Das wird bei einem Blick in das nordamerikanische Herkunftsgebiet deutlich. Andere in Nordamerika bedeutsame Arten wurden bisher nicht nach Mitteleuropa eingeschleppt oder haben sich zumindest nicht etabliert. Die Möglichkeit der Einschleppung lässt sich aber nicht ausschließen. Wegen dieser Gefährdung sollte die Roteiche nicht als Reinbestand, sondern in Mischung mit anderen Baumarten eingebracht werden.
Waldschutz hat die Vorbeugung gegen und die Vermeidung von bestandsbedrohenden Situationen zum Ziel. Daher ist nicht der einzelne Baum und auch nicht die Baumart, sondern ihre Einbindung im Bestandsgefüge entscheidend. Dazu ist die standörtliche Eignung unbedingt zu beachten.
Anbaurisiko
 Zoombild vorhanden
Zoombild vorhanden
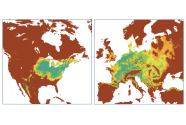
Abb. 7: Klimatisches Anbaurisiko der Roteiche in Nordamerika und Europa.
Dieser Ansatz wurde auch für die Anbaurisikoabschätzung der Roteiche (Abbildung 7, 8) verwendet. Im Einklang mit den oben beschriebenen Klimalimitierungen der Roteiche wurden Sommerniederschlag, Sommertemperatur und Wintertemperatur als erklärende Variablen gewählt. Für die nicht-heimische Roteiche wurden Vorkommensdaten in Form von Waldinventuren, sowohl aus ihrem natürlichen Verbreitungsgebiet in Nordamerika als auch aus ihrem Anbaugebiet in Europa, kombiniert (Forest Service 2023, Mauri et al. 2017, National Forest Inventory 2023).
 Zoombild vorhanden
Zoombild vorhanden
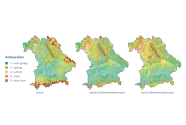
Abb. 8: Anbaurisiko Bayern mit Einbezug von Boden- und Standortsansprüchen, von links nach rechts: heute (Referenzperiode 1991–2020, DWD-Rasterdaten), mittleres Klimawandelszenario (+2,0 °C Jahresmitteltemperatur, 2100 gegenüber 2000, Model: MPI-ESM RCA4 RCP 4.5, DWD-Rasterdaten) und hartes Klimawandelszenario (+3,1°C Jahresmitteltemperatur, 2100 gegenüber 2000, Model: MPI-ESM CLM RCP 8.5, DWD-Rasterdaten).
In Nordamerika decken sich die Regionen, die mit sehr geringem bis geringem Anbaurisiko bewertet werden, mit dem natürlichen Verbreitungsgebiet. Zusätzlich werden an der Westküste sowie in Hochlagen in Nordmexiko weitere mögliche Regionen mit geringem oder sehr geringem Anbaurisiko identifiziert (Abbildung 7). In Europa umfassen die Gebiete mit sehr geringem und geringem Anbaurisiko die Länder Frankreich, Deutschland, Polen, Tschechien, Slowakei, Österreich und Slowenien sowie die Benelux-Staaten. Die ozeanisch-geprägte französische Atlantikküste und die Höhenlagen der Alpen, Karpaten, Pyrenäen, des Zentralmassivs und der deutschen und tschechischen Mittelgebirge sind ausgespart, hier wird der Wärmeanspruch der Roteiche ebenso wie in Nordeuropa nicht erfüllt (Abbildung 7). Im mediterranen Raum werden nur in Gebirgen wie den Rhodopen in Griechenland, dem Apennin in Italien oder dem Pontischen Gebirge entlang der Schwarzmeerküste Gebiete mit geringem klimatischem Anbaurisiko gefunden. In tieferen Lagen in der Mittelmeerregion ist dagegen die Sommertemperatur zu hoch und der Sommerniederschlag zu gering.
Bezogen auf Bayern hat die Roteiche aktuell (Referenzperiode 1991– 2020, DWD-Rasterdaten) außerhalb der höheren Lagen in den ostbayerischen Mittelgebirgen und den Alpen in weiten Teilen Bayerns ein sehr geringes bis geringes Anbaurisiko (Abbildung 8). Zukünftig ergeben sich aufgrund der steigenden Sommertemperaturen neue Anbauräume vor allem in höheren, heute noch kälteren Lagen. Bei einem mittleren (+ 2,0 °C Jahresmitteltemperatur, 2100 gegenüber 2000, Model: MPI-ESM RCA4 RCP 4.5, DWD-Rasterdaten) oder harten Klimawandelszenario (+ 3,1 °C Jahresmitteltemperatur, 2100 gegenüber 2000, Model: MPI-ESM CLM RCP 8.5, DWD-Rasterdaten) kommen jedoch auch neue Risikostandorte hinzu, wie z. B. in Teilen Unter- und Mittelfrankens, im nördlichen Frankenjura und am Rande des Oberpfälzer Beckens. Weitgehend unabhängig vom Klima finden sich für die Roteiche in Bayern zusätzliche bodenbezogene Risikostandorte, so z. B. die Kalkstandorte des fränkischen Jura, die Moore des Alpenvorlandes und der Mittelgebirge und die Überschwemmungsstandorte entlang der Flussläufe.
Während im jetzigen Klima die Roteiche in den meisten Regionen Bayerns als risikoarme Alternativbaumart anzusehen ist, fällt sie bei einem mittleren und harten Klimawandelszenario auf der Fränkischen Platte und am Untermain in die erhöhte bis sehr hohe Anbaurisikoklasse. Mit dieser Einwertung liegt das Risiko für die Roteiche höher als das der einheimischen Stiel- und Traubeneiche. Dennoch wurden auch eigene Beobachtungen gemacht, in denen sich die Roteichen nach den trockenen Jahren 2018 – 2020 vitaler präsentierten als benachbarte einheimische Eichen. Da diese Bestände jedoch bisher Einzelbeobachtungen darstellen, findet sich in unseren Daten (noch) keine Evidenz dafür, dass die Roteiche besser als angenommen mit Trockenheit umgehen könnte – weder in den natürlichen Herkunftsgebieten noch innerhalb der bisherigen Anbaugebiete in Europa. Letztere beinhalten zwar Gebiete mit trockenen Sommern, allerdings bei deutlich geringeren Sommertemperaturen als im zukünftigen Klima dieser Region. Der Ansatz, das Anbaurisiko aus den rezenten Vorkommensnachweisen abzuleiten, ist im Fall der Roteiche also eher konservativ. Diese Einschätzung würde sich jedoch bei mehr Evidenz von erfolgreichen Anbauten unter warm-trockeneren Klimabedingungen ändern.
Fazit
Die Roteiche (Quercus rubra L.) stammt aus dem Osten der USA und dem Süden Kanadas. Sie ist die am weitesten verbreitete nichtheimische Laubbaumart in Deutschland. Der Schwerpunkt des europäischen Roteichenanbaus liegt in einem Klima, das wesentlich ozeanischer, also wintermilder und sommerkühler, und niederschlagsärmer ist als das des nordamerikanischen Verbreitungsgebiets. Das Anbaurisiko der Roteiche im Klimawandel wurde basierend auf Waldinventurdaten aus Nordamerika und Europa hergeleitet, um die in den beiden Herkunftsräumen zum Teil abweichenden klimatischen Nischen zu berücksichtigen und das klimatische Potenzial der Roteiche aufzuzeigen. Im Endeffekt präsentiert sich die Roteiche in ihrem europäischen Anbauschwerpunkt ähnlich den einheimischen Eichen als kältetolerante, wärmeliebende Art mit geringen Niederschlagsansprüchen, die ihr Wuchsoptimum bei gut wasserversorgten, nicht zu heißen oder zu kühlen Bedingungen findet. Ihre Konkurrenzkraft gegenüber einheimischen Baumarten entfaltet die Roteiche hingegen vor allem bei warmen, trockenen Bedingungen auf eher nährstoffarmen Standorten. Weitere wichtige Unterschiede zu den einheimischen Eichenarten sind die niedrigere Kalktoleranz, die gerade in Kombination mit einer niedrigen Wasserhaltekapazität die Infektion mit pilzlichen Schaderregern fördert, und die höhere Schattentoleranz. Letztere ermöglicht einen Voranbau z. B. in lichten Kiefernwäldern auch auf günstigeren Standorten, wo eine starke Auflichtung die Brombeere begünstigen würde.
Insgesamt stellt die Roteiche mit ihrer Schattentoleranz, der breiten Standortsamplitude und der bisher noch unauffälligen Waldschutzsituation an vielen Standorten in Bayern eine attraktive Ergänzung der Baumartenpalette dar. Da die Schäden in den nordamerikanischen Herkunftsgebieten gravierender sind sowie aus ökologischen Gründen empfehlen wir den Anbau dieser nichteinheimischen Baumart ausschließlich in Mischung mit einheimischen Baumarten. Auch in Zukunft kann die Roteiche in weiten Teilen Bayerns mit geringem bis sehr geringem Anbaurisiko angebaut werden. Allerdings kann sie bei einem harten Klimawandelszenario in heiß-trockenen Regionen wie der Fränkischen Platte an ihre Grenzen kommen. Es gibt jedoch auch Hinweise aus der Literatur und aus Beobachtungen, dass die Roteiche möglicherweise trockeneres Klima besser verträgt als es die Daten zur bisherigen Verbreitung vermuten lassen. Hier kann die Forstpraxis und -wissenschaft mit weiteren Anbauversuchen auf diversen Standorten und mit diversen Herkünften aus Europa und dem natürlichen Verbreitungsgebiet zum weiteren Wissensgewinn beitragen.
Literatur
- Abrams, M.D. (1990): Adaptations and responses to drought in Quercus species of North America. In: Tree Physiology (7), S. 227-238
- Badoux, H. (1932): Die forstlich wichtigsten exotischen Holzarten in der Schweiz. Zürich. Mitteilungen der Schweizerischen Zentralanstalt für das forstliche Versuchswesen 17, 344-438
- Bauer, F. (1953): Die Roteiche. Frankfurt a. M.: JD Sauerländer
- Bayerische Landesanstalt für Wald und Forstwirtschaft (LWF) (Hg.) (2020): Praxishilfe Klima-Boden-Baumartenwahl Band II, Freising, 124 S.
- Booth, T.H. (2017): Assessing species climatic requirements beyond the realized niche. Some lessons mainly from tree species distribution modelling. In: Climatic Change 145 (3-4), S. 259–271. DOI: 10.1007/s10584-017-2107-9
- Cech, T.; Brenn, M.; Schwanda, K. (2023): Wurzelfäule als Konsequenz klimatischer und standörtlicher Einschränkungen der Roteiche. Forstschutz aktuell 68: 35-41. Online unter: https://www.bfw.gv.at/wp-content/uploads/FS-Aktuell_68_5.pdf (abgerufen 07.04.2025)
- Chytry, M.; Tichy, L.; Dřevojan, P.; Sadlo, J.; Zeleny, D. (2018): Ellenberg-type indicator values for the Czech flora. In: Preslia 90 (2), S. 83-103
- Columbia Climate School (11.04.2018): The 100th Meridian, Where the Great Plains Begin, May Be Shifting. Krajick, Kevin. Online verfügbar unter https://news.climate.columbia. edu/2018/04/11/the-100th-meridian-where-the-great-plains-usedto-begin-now-moving-east/, zuletzt geprüft am 12.04.2025
- Daubree, J.B.; Kremer, A. (1993): Genetic and phenological differentiation between introduced and natural populations of Quercus rubra L. Annals of Forest Science 50, 271-280
- Demchik, M.C.; Sharpe, W.E. (2000): The effect of soil nutrition, soil acidity and drought on northern red oak (Quercus rubra L.) growth and nutrition on Pennsylvania sites with high and low red oak mortality. Forest Ecology and Management. 136(1): S. 199-207
- Dresel, R.; Jager, E.J. (2002): Beiträge zur Biologie der Gefäßpflanzen des herzynischen Raumes. 5. Quercus rubra L.(Roteiche): Lebensgeschichte und agriophytische Ausbreitung im Nationalpark Sächsische Schweiz. In: Hercynia-Ökologie und Umwelt in Mitteleuropa 35 (1), S. 37-64
- Dyderski, M.K.; Chmura, D.; Dylewski, L.; Horodecki, P.; Jagodziński, A.M.; Pietras, M.; Robakowski, P.; Woziwoda, B. (2020): Biological Flora of the British Isles: Quercus rubra. Journal of Ecology 108:1199-1225. DOI: 10.1111/1365-2745.13375
- EPPO (2025): Bretziella fagacearum. EPPO datasheets on pests recommended for regulation. https://gd.eppo.int (abgerufen 10.04.2025)
- Eyre, F.H. (Hg.) (1980): Forest cover types of the United States and Canada. Washington D.C.: Society of American Foresters Forstliche Versuchs- und Forschungsanstalt Baden-Wurttemberg (FVA) (2021): Artsteckbriefe 2.0. Alternative Baumarten im Klimawandel; Eine Stoffsammlung. Online unter https://www.fvabw.de/fileadmin/publikationen/sonstiges/2021_fva_artensteckbriefe.pdf, (abgerufen 08.04.2025)
- Forstliche Versuchs- und Forschungsanstalt Baden-Württemberg (FVA) (2021): Artsteckbriefe 2.0. Alternative Baumarten im Klimawandel; Eine Stoffsammlung. Online unter https://www.fva-bw.de/fileadmin/publikationen/sonstiges/2021_fva_artensteckbriefe.pdf, (abgerufen 08.04.2025
- Forstliche Versuchs- und Forschungsanstalt Baden-Württemberg (FVA). (2021). Quercus rubra. In Artensteckbriefe (S. 168–173). https://www.fva-bw.de/fileadmin/publikationen/sonstiges/2021_fva_artensteckbriefe.pdf . ISBN 978-3-933548-94-8
- Gohre, K.; Wagenknecht, E. (1955): Die Roteiche und ihr Holz. Berlin: Deutscher Bauernverlag. Online verfügbar unter https://d-nb.info/573490031
- Guiden, P.W.; Connolly, B.M.; Orrock, J.L. (2018): Extreme cold consistently reduces seedling growth but has species-specific effects on browse tolerance in summer. In: American journal of botany 105 (12), S. 2075–2080. DOI: 10.1002/ajb2.1203
- Haralamb, A.T. (1967): Culture of forest species. In: Agro-Silvică Ed., Bucharest (in Romanian)
- Hayda, Y.; Mohytych, V.; Bidolakh, D.; Kuzovych, V.; Sulkowska, M. (2022): The introduction of red oak (Quercus rubra L.) in Ukrainian forests: advantages of productivity versus disadvantages of invasiveness. Folia Forestalia Polonica. Series A. Forestry, 64(4)
- Heikkinen, R. K.; Marmion, M.; Luoto, M. (2012): Does the interpolation accuracy of species distribution models come at the expense of transferability? In: Ecography 35 (3), S. 276-288
- Heydeck, P., Majunke C. (2002): Gefährdung ausgewählter ausländischer Baumarten durch biotische und abiotische Schadeinwirkungen. In: Ministerium für Landwirtschaft, Umweltschutz und Raumordnung des Landes Brandenburg (Hrsg.) Ausländische Baumarten in Brandenburgs Wäldern. Potsdam, 172-180
- Horak, R.; Župunski, M.; Pajević, S.; Borišev, M.; Arsenov, D.; Nikolić, N.; Orlović, S. (2019): Carbon assimilation in oak (Quercus spp.) populations under acute and chronic high-temperature stress. In: Photosynt. 57 (3), S. 875–889. DOI: 10.32615/ps.2019.090
- IGN – Institute nacional de l’information geographique et forestiere: https://inventaire-forestier.ign.fr/?article1035 (abgerufen 10.04.2025)
- Kaulfus, S. (2011): Waldbauliche Maßnahmen zur Waldbrandvorbeugung. http://www.waldwissen.net (abgerufen 01.04.2025)
- Keller, G. J., Bronson, D., Slesak, R. A., & Windmuller-Campione, M. A. (2024). Effects of Flooding and Shade on Survival, Growth, and Leaf Gas Exchange of Bottomland Tree Species across the Great Lakes Region (USA). Forests, 15(3), 530. https://doi.org/10.3390/f15030530
- Klemmt, H.-J.; Neubert, M.; Falk, W. (2013): Das Wachstum der Roteiche im Vergleich zu den einheimischen Eichen. Ein innerbayerischer Leistungsvergleich zeigt Stärken und Schwächen der Gastbaumart. In: LWFaktuell 20 (97), S. 28–31. Online verfügbar unter https://www.lwf.bayern.de/mam/cms04/service/dateien/ a97_raumplanung_in_den_alpen_gesamtheft_bf_gesch.pdf, zuletzt geprüft am 14.04.2025
- Kormann, J.M.; van der Maaten, E.; Liesebach, M.; Liepe, K.J.; van der Maaten-Theunissen, M. (2024): High risk, high gain? Trade-offs between growth and resistance to extreme events differ in northern red oak (Quercus rubra L.). In: Frontiers in Plant Science (15). Online verfügbar unter doi: 10.3389/fpls.2024.1374498
- Krahl-Urban, J. (1966): Vorläufige Ergebnisse eines Roteichen-Provenienzversuchs. Allgemeine Forst- und Jagdzeitung 137, 91-100
- Kuehne, C.; Nosko, P.; Horwath, T.; Bauhus, J. (2014): A comparative study of physiological and morphological seedling traits associated with shade tolerance in introduced red oak (Quercus rubra) and native hardwood tree species in southwestern Germany. In: Tree Physiol 34 (2), S. 184–193. DOI: 10.1093/treephys/tpt124
- Kupka, I.; Vopalka-Melicharova, L. (2020): Northern red oak (Quercus rubra L.) as a species suitable for the upcoming seasons with frequent dry periods. In: Central European Forestry Journal 66 (2), S. 97–103. DOI: 10.2478/forj-2020-0003
- Larcher, W. (1981): Resistenzphysiologische Grundlagen der evolutiven Kälteakklimatisation von Sproßpflanzen. In: Plant Systematics and Evolution 137, S. 145–180. Online verfügbar unter https://doi.org/10.1007/BF00989871
- Lee, C.A., Frankel, S.J., Rizzo D.M. (2019): Phytophthora ramorum and Congenerics: Global Threats to Oaks. International Oaks No. 30: 349-356
- Liesebach, M.; Schneck, V. (2011): Entwicklung von amerikanischen und europäischen Herkünften der Roteiche in Deutschland. Forstarchiv 82, 125-133
- Little, Elbert L. (1971): Atlas of United States trees volume 1 Conifers and important hardwoods. Washington, D.C: U.S. Dept. of Agriculture, Forest Service (no.1146)
- Magni Diaz, C. R. (2004). Reconstitution de l’introduction de Quercus rubra L. en Europe et conséquences génétiques dans les populations allochtones [Doctoral dissertation, École Nationale du Génie Rural, des Eaux et des Forêts].
- Majekova, J.; Medvecka, J.; Mikulova, K.; Slabejova, D.; Šibikova, M.; Zaliberova, M.; Škodova, I. (2024): Structure of forest stands of alien tree Quercus rubra in Central Europe. Biologia, 79(4), 1169-1176
- Major, K. C., Nosko, P., Kuehne, C., Campbell, D., & Bauhus, J. (2013). Regeneration dynamics of non-native northern red oak (Quercus rubra L.) populations as influenced by environmental factors: A case study in managed hardwood forests of southwestern Germany. Forest Ecology and Management, 291, 144-153.
- Matthiopoulos, J. (2022): Defining, estimating, and understanding the fundamental niches of complex animals in heterogeneous environments. In: Ecological Monographs 92 (4), S. 173. DOI: 10.1002/ecm.1545
- Mellert, K.H.; Fath, J.; Falk, W.; Wellbrock, N.; Gottlein, A. (2020): Die ökologische Basenamplitude von Baumarten in Deutschland. Allgemeine Forst- und Jagdzeitung, 184-199
- Merceron, N. R., Leroy, T., Chancerel, E., Romero-Severson, J., Borkowski, D. S., Ducousso, A., ... & Kremer, A. (2017). Back to America: tracking the origin of European introduced populations of Quercus rubra L. Genome, 60(9), 778-790
- Metzler, B.; Halsdorf, M.; Franke, D. (2010): Befallsbedingungen für Wurzelfäule bei Roteiche. AFZ-Der Wald, 65/3: 26-28. Online unter: https://www.waldwissen.net/de/waldwirtschaft/schadensmanagement/pilze-und-nematoden/wurzelfaeule-beiroteiche (abgerufen 08.04.2025)
- Miltner, S.; Kupka, I. (2016): Silvicultural potential of northern red oak and its regeneration-Review. Journal of Forest Science, 62(4), 145-152
- Miltner, S.; Kupka, I.; Třeštik, M. (2016): Effects of Northern red oak (Quercus rubra L.) and sessile oak (Quercus petraea (Mattusch.) Liebl.) on the forest soil chemical properties. Central European Forestry Journal, 62(3), 169-172
- Nagel, R.-V. (2015): Roteiche (Quercus rubra L.). In: Vor, T., Spellmann, H., Bolte, A., Ammer, C. (Hg.) Potenziale und Risiken eingeführter Baumarten. »Göttinger Forstwissenschaften« im Universitätsverlag Göttingen, Bd. 7. S. 219-267 Online unter https://univerlag.uni-goettingen.de/bitstream/handle/3/isbn-978-3-86395-240-2/GoeForst7_baumarten.pdf?sequence=4 (abgerufen 08.04.2025)
- Nagel, R.-V. (2018): Die Roteiche in Norddeutschland. Ergebnisse von Versuchsflächen der Nordwestdeutschen Forstlichen Versuchsanstalt in Niedersachsen, Schleswig-Holstein und Sachsen-Anhalt. Gesellschaft zur Förderung schnellwachsender Baumarten in Norddeutschland. Grevesmühlen (Mitteilungen, 5). Online verfügbar unter https://www.gesellschaft-schnellwachsende-baumarten.de/wp-content/uploads/2023/12/mtb-05_2018-roteiche.pdf (abgerufen am 29.04.2025)
- Nesom, G. (2001): NORTHERN RED OAK Quercus rubra L. Unter Mitarbeit von United States Department of Agriculture, Natural resources Conservation Service und National Plant Data Center. United States Department of Agriculture, Natural resources Conservation Service (Plant Guide)
- Nicolescu, V.-N.; Vor, T.; Mason, W.L.; Bastien, J.-C.; Brus, R.; Henin, J.-M.; Kupka, I.; Lavnyy, V.; La Porta, N.; Mohren, F.; Petkova, K.; Redei, K.; Štefančik, I.; Wąsik, R.; Perić, S.; Hernea, C. (2020): Ecology and management of northern red oak (Quercus rubra L. syn. Q. borealis F. Michx.) in Europe: A review. Forestry: An International Journal of Forest Research, Volume 93, Issue 4, July 2020, Pages 481-494, https://doi.org/10.1093/forestry/cpy032
- Nieukerken, E.J.; Doorenweerd, C.; Ellis, W.N.; Huisman, K.J.; Koster, J.C.; Mex, W.; Muus, T.S.; Schreurs, A. (2012): Bucculatrix ainsliella Murtfeldt a new North American invader widespread on northern red oaks (Q. rubra) in West-Europe (Bucculatricidae). Nota Lepidopterologica 35 (2), 135-159. Online unter: https://www.researchgate.net/publication/236172584_Bucculatrix_ainsliella_Murtfeldt_a_new_North_American_invader_already_widespread_on_northern_red_oaks_Quercus_rubra_in_Western_Europe_Bucculatricidae (abgerufen am 08.04.2025)
- Niinemets, U.; Valladares, F. (2006): Tolerance to shade, drought, and waterlogging of temperate northern hemisphere trees and shrubs. In: Ecological Monographs 76 (4), S. 521-547
- O’Brien, J.G.; Mielke, M.E.; Starkey, D., Juzwik, J. (2011): How to Identify, Prevent, and Control Oak Wilt. USDA Forest Service, Newton Square, PA: Northeastern State and Private Forestry. 30 S. Online unter: https://erc.cals.wisc.edu/woodlandinfo/files/2017/09/NA%E2%80%93FR%E2%80%9301%E2%80%9311.pdf (abgerufen 08.04.2025)
- Peel, M.C.; Finlayson, B.L.; McMahon, T.A. (2007): Updated world map of the Köppen-Geiger climate classification. In: Hydrology and Earth System Sciences 11 (5), S. 1633-1644. DOI: 10.5194/hess-11-1633-2007
- Pilar-Landeau, B. (1984). Northern red oak: sites, production and silviculture in the south-west of France. Mémoire de stage 3e année de l’ENITEF. Laboratoire INRA de Sylviculture et Ecologie, Nancy, 65.
- Rolando, M.; Ganugi, P.; Secchi, F.; Said-Pullicino, D.; Bonifacio, E.; Celi, L. (2025): Response of native (Quercus robur L.) and alien (Quercus rubra L.) species to water stress and nutrient input in European temperate ecosystems. In: Physiologia Plantarum (177). Online verfügbar unter https://doi.org/10.1111/ppl.70070
- Sander, I.L. (1990): Quercus rubra L. Northern red oak. In: Silvics of North America 2, S. 727-733
- Savill, P. (2013): The silviculture of trees used in British forestry. 2. Aufl. Wallingford, Oxon: CABI Publishing
- Schwappach, N. A. (2013). Die Ergebnisse der in den Preußischen Staatsforsten ausgeführten Anbauversuche mit fremdländischen Holzarten. Springer-Verlag. DOI: 10.1007/978-3-642-92242-8.
- Schwappach, W.K. (1908). Nachruf. John Booth und Franz Ganghofer. Mitteilungen der Deutschen Dendrologischen Gesellschaft 17, 5-8.
- Sobczyk, T. (2019): Rot-Eiche (Qercus rubra) und phytophage Schmetterlingsarten (Lepidoptera) – ist die Rot-Eiche eine Alternative zu heimischen Eichen-Arten? Naturschutz und Landschaftspflege ein Brandenburg. Online unter: https://www.researchgate.net/publication/344868885_Rot-Eiche_Quercus_rubra_und_phytophage_Schmetterlingsarten_Lepidoptera_-_ist_die_Rot-Eiche_eine_Alternative_zu_heimischen_Eichen-Arten (abgerufen 08.04.2025)
- Sobczyk, T.; Otti, O.; Reinhardt, K.; Schmidt, C. (2024): Erstnachweise der Australischen Wollschildlaus Icerya purchasi (Maskell, 1878) und der Seychellen-Schildlaus Icerya seychellarum (Westwood, 1855) in Sachsen und Bayern (Insecta. Coccoidea: Monophlebidae). In: Journal für Kulturpflanzen 76 (01), S. 53-59
- Sofletea, N.; Curtu, L. (2007): Dendrologie: Editura Universitatii Transilvania din Brasov
- Soil Conservation Service, U.S. Department of Agriculture (Hg.) (1977): Soil Taxonomy. A Basic System of Soil Classification for Making and Interpreting Soil Surveys. Unter Mitarbeit von Soil Survey Staff, coord. U.S. Department of Agriculture. Soil Conservation Service, U.S. Department of Agriculture. 2009/05/01. Washington DC: Cambridge University Press (Agriculture Handbook No. 436, 114). Online verfügbar unter http://dx.doi.org/10.1017/S0016756800045489
- Stephen, F.M.; Salisbury, V.B.; Oliveria, F.L. (2001): Red Oak Borer, Enaphalodes rufulus (Coleoptera. Cerambycidae), in the Ozark Mountains of Arkansas, U.S.A.: An Unexpected and Remarkable Forest Disturbance. In: Integrated Pest Management Reviews 6 (3), S. 247–252. DOI: 10.1023/A:1025779520102
- Stern, R.L.; Schaberg, P.G.; Rayback, S.A.; Murakami, P.F.; Hansen, C.F.; Hawley, G.J. (2020): Growth of canopy red oak near its northern range limit. Current trends, potential drivers, and implications for the future. In: Can. J. For. Res. 50 (10), S. 975-988. DOI: 10.1139/cjfr-2019-0200
- Thurm, E., & Falk, W. (2019). Standortsansprüche seltener Baumarten. AFZ-DerWald, 15, 32.
- Timbal, J., Dewilder, R. (1994): Sensibilité au calcaire. In: Timbal, J., Kremer, A., Le Goff, N., Nepveu, G. (eds.): Le chene rouge d’Amerique. INRA, Paris: 98-100
- Vor, T. (2005): Natural regeneration of Quercus rubra L. (Red Oak) in Germany. S. 111-123 in: Nentwig, W., Bacher, S., Cock, M. J.W., Dietz, H., Gigon, A., Wittenberg, R. (eds.) Biological Invasions – From Ecology to Control. Proceedings of the International Conference on Biological Invasions »Neobiota« held in 2004 at the University of Bern, Switzerland
- Vor, T.; Lupke, B. v. (2004): Das Wachstum von Roteiche, Traubeneiche und Rotbuche unter verschiedenen Lichtbedingungen in den ersten beiden Jahren nach der Pflanzung. In: Forstarchiv 75, S. 13-19
- Vor, T.; Lupke, B. v.: Waldbauliche Möglichkeiten für den Einsatz von Roteichen (Quercus rubra L.) in Buchenmischbeständen. Gutachten. Inst. f. Waldbau. Abt. 1. Waldbau der Georg-August- Universität Göttingen
- Walter, H.; Breckle, S.-W. (1991): Spezielle Ökologie der Gemäßigten und Arktischen Zonen außerhalb Euro-Nordasiens. Zonobiom IV-IX. Unter Mitarbeit von J. Hager und Loris, K., Miehe, G. Stuttgart: Gustav Fischer Verlag (Ökologie der Erde: Geo-Biosphäre, 4)
- Wittland, W. (2014): Aktuelle Verbreitung der nordamerikanischen Art Bucculatrix ainsliella (Murtfeldt, 1905) in Deutschland (Lep. Bucculatricidae). Melanargia 26 (4), 204-213
- Yamaguchi, D.P.; Mishima, D.; Nakamura, K.; Sano, J.; Nakaji, T.; Hiura, T.; Hikosaka, K. (2019): Limitation in the Photosynthetic Acclimation to High Temperature in Canopy Leaves of Quercus serrata. In: Front. For. Glob. Change 2, S. 1095. DOI: 10.3389/ffgc.2019.00019
- Zurell, D.; Franklin, J.; Konig, C.; Bouchet, P.J.; Dormann, C.F.; Elith, J. et al. (2020): A standard protocol for reporting species distribution models. In: Ecography 43 (9), S. 1261–1277. DOI: 10.1111/ecog.04960
Verwendete Datensätze
- Vorkommmensdaten der Roteiche in Europa:
- GBIF.org (27.11.2023) GBIF Occurrence Download. https://doi.org/10.15468/dl.3qb4vj
- IGN – Institute nacional de l’information geographique et forestiere https://inventaire-forestier.ign.fr/?article1035 (abgerufen 10.04.2025)
- Mauri, A.; Strona, G.; San-Miguel-Ayanz, J. (2017): A high-resolution pan-European tree occurrence dataset. [Data set] fig share. Collection. https://doi.org/10.6084/m9. figshare.c.3288407.v1
- Thünen-Institut, Dritte Bundeswaldinventur (BWI; 2012) - Ergebnisdatenbank, https://bwi.info, Aufruf: [Mai 2025]
- Vorkommmensdaten der Roteiche in den USA:
- Forest Service (2023): Nationwide Forest Inventory. (Version 9.3) [Data set]. U.S. Department of Agriculture. Website down/Trumpadministration.
- Vorkommmensdaten der Roteiche in Kanada:
- National Forest Inventory (2023): Baseline Measurement Standard Reports, https://nfi.nfis.org/en/statisticalreports. National Forest Inventory (2023): Canada’s National Forest Inventory– ground-plot data, version 3.0.[Data set]
- Klimadaten:
- Brun, P.; Zimmermann; N.E.; Hari, C.; Pellissier, L.; Karger, D.N. (2022): Global climate-related predictors at kilometre resolution for the past and future. Earth Syst. Sci. Data Discuss. https://doi.org/10.5194/essd-2022-212
- Karger, D.N.; Conrad, O.; Bohner, J.; Kawohl, T.; Kreft, H.; Soria-Auza, R.W.; Zimmermann, N.E.; Linder, H.P.; Kessler, M. (2018): Data from: Climatologies at high resolution for the earth’s land surface areas. EnviDat. https://doi.org/10.16904/envidat.228.v2.1
- DWD-Rasterdaten Bayern
- Bayrisches Landesamt für Umwelt (LfU, 2020). Bayrische Klimadaten-Klimaprojektionsensemble. www.lfu.bayern.de
- Bayrisches Landesamt für Umwelt [Hrsg.] (2020): Bayrische Klimadaten-Beobachtungsdaten, Klimaprojektionsensemble und Klimakennwerte für Bayern, Augsburg: 12 S.
Beitrag zum Ausdrucken
Weiterführende Informationen
Autoren
- Melina Schaller
- Wolfgang Falk
- Dr. Andreas Hahn
- Dr. Tobias Mette



