LWF Wissen 88
Aspekte zu Vermehrungsgut, Genetik und Erhaltung der Mehlbeere (Sorbus aria (LINNÉ) CRANTZ)
von Barbara Fussi, Daniel Glas und Muhidin Šeho
Die Mehlbeere ist eine wertvolle Baumart im Klimawandel. Dabei stellen sich verschiedene Herausforderungen an Ernte, Lagerung und Saatgutaufbereitung der Mehlbeeren. Ihr Pollen wird durch Insekten und ihre Früchte über Vögel verbreitet. Die Mehlbeere neigt stark zur Polyploidisierung und Hybridisierung und ist taxonomisch schwer einzuordnen. Daher ist die Anwendung von genetischen Markern bei der Bewertung von Populationen der Mehlbeere unverzichtbar. Mit den angewandten genetischen Markern konnte die Artdifferenzierung von Mehlbeere zu Vogel- und Elsbeere vorgenommen werden. Zum Vergleich wurden genetische Proben aus den AWG Samenplantagen der drei Baumarten herangezogen. Die genetische Variation war in allen drei Samenplantagen hoch. Zudem konnten bei der Mehlbeere nur diploide Bäume identifiziert werden. Handlungsbedarf besteht bei der Erhaltung und Nutzung der forstlichen Genressourcen der Mehlbeere in Bayern. Dafür sind genetische Analysen von Teilarealen der diploiden Mehlbeere sowie endemischen Kleinst-Unterarten (triploid) dringend erforderlich. Nach dem Vorliegen der Ergebnisse können Erhaltungs- oder Saatguterntebestände ausgewiesen werden.
Eigenschaften und Forschungsgrundlagen
Die Echte oder Gewöhnliche Mehlbeere (Sorbus aria) ist eine Baumart aus der Familie der Rosengewächse. Als Solitärbaum erreicht sie bei uns Höhen von 10 bis 15 Meter (Maier 2014, Fenner 2023). In der Literatur wird ihr Maximalalter mit 200 Jahren angegeben (Maier 2014, Amann 1954, Fenner 2023), der Zuwachs kulminiert bei 50 bis 60 Jahren (Maier 2014). Sie hat eine ausgeprägte Tendenz zu spannrückigen und krummschäftigen Stammformen, einer oval-pyramidialen Krone und einem tiefreichenden Herzwurzelsystem (Maier 2014). Die Mehlbeere ist frosthart, licht- und wärmeliebend, daher wächst sie häufig am Waldrand, in Heidelandschaften, sowie auf Mager- und Trockenrasen (Fenner 2023). Die Halblicht- bis Halbschattbaumart gehört zu den Pionierbaumarten auf Waldkahlflächen (Maier 2014). Wegen ihrer Lichtbedürftigkeit kommt sie in Waldbeständen wie Buchenwäldern mit hoher Deckung in der Regel nicht vor (Meyer 2010). Ihr Optimum sind sommerwarme, trockenheitsertragende Eichen-Mischwälder, sowie wärmegeprägte Buchenwälder (Maier 2014). Da sie ein langsames Höhen- und Stärkewachstum besitzt, ist sie sehr konkurrenzschwach und meist nur als Mischbaumart eingestreut beteiligt (Maier 2014). Sie kann sich auf Grund ihres tiefreichenden kräftigen Herzwurzelsystems, einem vitalen Ausschlagvermögen und ihrer Genügsamkeit gegenüber Schurf- und Steinschlagverletzungen hervorragend auf felsigen, steilen und flachgründigen, licht- und wärmebegünstigten Standorten behaupten (Maier 2014). Hier wächst sie jedoch meist strauchförmig und/oder mehrstämmig (Maier 2014, Fenner 2023).
Die Mehlbeere ist wesentlich anspruchsvoller an den Nährstoffgehalt des Bodens als ihre nahe Verwandte die Vogelbeere, außerdem hat sie einen höheren Wärmebedarf (Namwar und Spethmann 1985). Sie stockt gerne auf kalkreichen Böden, ist jedoch nicht auf Kalk im Boden angewiesen. Auf quarzhaltigen Böden kommt sie nicht vor (Fenner 2023). Aufgrund dieser Ansprüche an den Boden besiedelt sie meist trockene Rendzinen, wächst jedoch ebenso auf mäßig frischen, mittelgründigen Hangschuttböden (Maier 2014).
Die lichtliebende Mehlbeere ist nach der letzten Eiszeit über das südöstliche Europa eingewandert und ist heute rund um das westliche Mittelmeer und in Teilen von West- und Mitteleuropa zu Hause (Fenner 2023). Die Baumart hat bei der nacheiszeitlichen Wiederbewaldung vermutlich vor allem auf lichten Hangkanten und Felshängen überlebt (Meyer 2010).
Die Mehlbeere ist eine wertvolle Pionierbaumart für extrem heiße und trockene Standorte und ist damit eine unverzichtbare Vorwaldbaumart als Bodenschutzholz, zur Humusanreicherung und der Verbesserung des Wasserhaushalts (Maier 2014, Namwar und Spethmann 1985). Gerade auf trockenen, flachgründigen Standorten, Böschungen, Schutzhecken, Steilhängen und auf Rohböden stellt sie eine wichtige Baumart dar und wird bei Schutzwaldsanierungen in Bergmischwäldern der bayerischen Alpen genutzt (Maier 2014, Verstl 1997, Namwar und Spethmann 1985). Aufgrund ihres zähen Holzes kann sie Lawinenabbrüche verhindern und verträgt Seewind (Verstl 1997).
Oft wird die Mehlbeere allerdings aufgrund ihres langsamen Wachstums rasch von konkurrierenden Baumarten verdrängt oder vielfach bei Durchforstungen aus den Beständen entfernt (Meyer 2010, Fenner 2023). Die oftmals fehlende forstwirtschaftliche Beachtung stellt eines der größten Probleme der Gattung Sorbus dar (Meyer 2010).
Saatgut und Vermehrung
Fruktifikation und Fortpflanzung
Die einhäusige Mehlbeere beginnt nach etwa 10 bis 20 Jahren zum ersten Mal zu fruktifizieren, ihr Blühzeitpunkt ist von Mai bis Juni (Maier 2014). Es kommen Lang-, Kurz- und Johannistriebe vor (Maier 2014). Die cremefarbenen, fünfzähligen, gestielten und aufrechten, schirmrispigen Blütenstände wachsen ausschließlich an den Kurztrieben (Maier 2014, Fenner 2023). Die Blüten bestehen aus 5 Kelch- und Blütenblättern, sind meist 2 griffelig, die Stiele und Kelche sind weißfilzig behaart und die Staubblätter stehen deutlich sichtbar heraus (Maier 2014, Fenner 2023).
Die Bestäubung der Mehlbeere erfolgt durch Insekten. Die Blüten der Mehlbeere sind auch als beliebte Bienenweide bekannt (Fenner 2023). Da die Arten der Gattung Sorbus generell und gerade die Mehlbeere im Speziellen als äußerst bastardierfreudig gelten und die daraus hervorgehenden Hybriden im Allgemeinen steril sind, nutzt die Baumart einen weiteren bemerkenswerten Weg der Fortpflanzung. Sie setzt hierbei auf die sogenannte Agamospermie, einen asexuellen Weg bei der sich keimfähige Samen ohne sexuelle Prozesse ausbilden (Meyer 2010). Bei diesen Nachkommen handelt es sich, da keine Befruchtung stattgefunden hat, um natürliche Klone der Mutterpflanze. Alle weiteren Nachkommen dieses Klons können sich ebenfalls über die ungeschlechtliche Art als sogenannte konstante Hybriden immer weiter vermehren (Meyer 2010, Fenner 2023). Darüber hinaus sind auch Rückkreuzungen bekannt (Meyer 2014). Allein in Süddeutschland und Thüringen wurden über dreißig solcher konstanten Hybriden entdeckt, welche mittlerweile als eigenständige Arten anerkannt wurden (Meyer 2010, Fenner 2023). Viele der endemischen Unterarten sind nur punktuell auf wenige Standorte beschränkt. Da teilweise nur an die 200 Exemplare existieren, gelten diese als stark gefährdet (Meyer 2010).
Frucht und Samen
Die Mehlbeerenfrüchte sind länglich bis rundlich oval, etwa 1 cm bis 1,5 cm dick und orange bis rot, selten braun-grünlich. Die Früchte sind geadert mit zahlreichen hellen Lenticellen (Maier 2014), das Fruchtfleisch hat keine Steinzellen, ist mehlig und enthält viel organische Säuren und Gerbstoffe (Verstl 1997). Die Fruchtstände sind sogenannte Wintersteher (Fenner 2023). In jeder Frucht befinden sich circa 2 bis 4, 5 bis 6 Millimeter lange, dreieckig-ovale zugespitzte, dunkelbraune Samen (Maier 2014).
Ernte und Klengung
Die Ernte der reifen Mehlbeerenfrüchte erfolgt ab September bis Mitte Oktober am stehenden Baum durch Schütteln auf vorher ausgelegte Netze (Burkart 2018). Anschließend werden die Früchte in Fässern oder Kübeln nachgereift, bis sie ausgereift und mürbe sind (Maier 2014, Burkart 2018). Hierbei sollten diese nicht antrocknen (Burkart 2018).
Die Extraktion der Samen erfolgt durch wiederholtes Pressen und Auswaschen des Fruchtfleisches durch Siebe, bis die reinen Samen zurückbleiben (Maier 2014, Burkart 2018). Die trockenen Samen werden anschließend eingelagert oder es kann mit der Stratifikation begonnen werden. In der Fachliteratur werden 2.750 bis 3.750 Korn/kg Früchte angegeben. Das Tausendkorngewicht (TKG) beträgt 18,5 Gramm (AWG-Saatgutprüfung). Es werden 50.000 bis 80.000 Korn/kg Samen mit circa 20.000 bis 40.000 Sämlingen/kg genannt (Burkart 2018).
Lagerung und Stratifikation
Die Lagerung erfolgt in luftdichten Glas- oder Kunststoffbehältern bei 0 bis – 6°C. Das Saatgut ist so 4 bis 6 Jahre lagerfähig. Die Stratifikation beginnt im November und dauert 4 – 5 Monate. Als Schädlinge werden Keimlingspilze und Schorf aufgeführt (Burkart 2018).
Im Rahmen des Projektes „Nährstoffsicherung mittels Pioniervegetation als Teil eines Katastrophenmanagements" wurden von 2019 bis 2022 Stratifikations- und Lagerungsversuche bei verschiedenen Gehölzen mit Pioniercharakter wie z. B. Hirschholunder und Mehlbeere durchgeführt. Die Stratifikation ist das Verfahren, welches zur Unterbrechung der Keimhemmung eingesetzt wird und unterscheidet sich zwischen den Baumarten. Das Saatgut wurde dazu mit feuchtem Sand vermischt und zur Brechung der Keimruhe vier Monate kalt, d.h. im Kühlschrank bei einer Temperatur von 4 °C, stratifiziert. Die Keimprüfung des Saatguts nach vollständiger Stratifikation auf Papier ergab 76,5 % tatsächlich gekeimte Samen.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 2: Keimungserfolg der Stratifikationsvariante „12 Wochen kalt, trocken + 3 Wochen Vorkühlung nach einem Jahr Lagerung bei – 10°C". (© M. Schneider, AWG)
Im Rahmen des Projektes war es ein wichtiges Ziel zu untersuchen, ob das Saatgut der Mehlbeere in einem Zustand eingelagert werden kann, der eine möglichst schnelle Keimung nach der Ausbringung gewährleistet. Um „vorstratifiziertes" und lagerfähiges Saatgut zu erhalten, wurde noch vor dem Beginn des Keimwurzelwachstums die Stratifikation (nach circa ¾ der Stratifikationsdauer) unterbrochen. Um den richtigen Zeitpunkt der Unterbrechung zu identifizieren, wurde die Stratifikation um sechs, vier bzw. zwei Wochen verkürzt. Dabei legte man jeweils drei „Untervarianten" für die Keimprüfung an, diese wurden in 2 Keimschalen mit je 100 Samen und mit einer Ausnahme (bei 18 W kalt, frisch (vollständig stratifiziert)) mit 4 Keimschalen mit je 100 Samen angesetzt.
Bei Variante 2 wurde das Saatgut nach der Rücktrocknung direkt in Keimschalen auf Filterpapier (2 Wiederholungen mit je 100 Samen) zur Keimprüfung angesetzt, bei Variante 3 lagerte man es vor der Keimprüfung zur Vorkühlung bei – 10 °C ein. Für die Keimung wurden die Keimschalen sechs Wochen in den Keimschrank für 16 h bei 20 °C und 8 h bei 30 °C gelegt. Die Ergebnisse der Auszählung von Keimlingen zeigte, dass die Samen hauptsächlich in den ersten zwei Wochen keimten (Tabelle 1). Nach einem Jahr Lagerung bei – 10°C wurde das vorstratifizierte Saatgut erneut auf Keimfähigkeit getestet. Es zeigt sich deutlich, dass die Keimfähigkeit der „frisch" angesetzten Samen mit zunehmender Dauer der Stratifikation steigt. Bei der Variante „rückgetrocknet mit dreiwöchiger Vorkühlung" verringern sich die Keimzahlen mit zunehmender Dauer der Stratifikation. Die Ursache dafür könnte das Wachstum der Keimwurzel und deren Schädigung (Abbrechen) sein.
Anzucht und Sortimente
Der Aussaatzeitpunkt in der Baumschule ist März bis April. Das Verschulalter liegt bei ein- bis zweijährigen Pflanzen und das Verkaufsalter liegt bei vier- bis fünfjährigen Pflanzen (2/2er bis 2/3er Sortimente) (Burkart 2018).
| Stratifikationsvariante | Anzahl | Beobachtungszeit | Keimfähigkeit |
|---|
| 12 W kalt, frisch | 2x100 | 6 Wochen | 23,5 % |
| 12 W kalt, trocken | 2x100 | 6 Wochen | 0,5 % |
| 12 W kalt, trocken + 3W VK | 2x100 | 6 Wochen | 81,5 % |
| 14 W kalt, frisch | 2x100 | 6 Wochen | 35,5 % |
| 14 W kalt, trocken | 2x100 | 6 Wochen | 5,5 % |
| 14 W kalt, trocken + 3W VK | 2x100 | 6 Wochen | 72,5 % |
| 16 W kalt, frisch | 2x100 | 6 Wochen | 74 % |
| 16 W kalt, trocken | 2x100 | 6 Wochen | 9 % |
| 16 W kalt, trocken + 3 W VK | 2x100 | 6 Wochen | 53 % |
| 18 W kalt, frisch (vollständig stratifiziert) | 4x100 | 6 Wochen | 76,5 % |
| 18 W kalt, trocken | 2x100 | 6 Wochen | 12 % |
| 18 W kalt, trocken + 3W VK | 2x100 | 6 Wochen | 12,5 % |
| Nach 1 Jahr Lagerung bei –10°C | | | |
| 12 W kalt, trocken | 2x100 | 4 Wochen | 1 % |
| 12 W kalt, trocken + 3W VK | 2x100 | 4 Wochen | 80 % |
| 14 W kalt, trocken | 2x100 | 4 Wochen | 2 % |
| 14 W kalt, trocken + 3W VK | 2x100 | 4 Wochen | 74,5 % |
| 16 W kalt, trocken | 2x100 | 4 Wochen | 9 % |
| 16 W kalt, trocken + 3W VK | 2x100 | 4 Wochen | 53 % |
Tabelle 1: Keimzahlen zu den verschiedenen Varianten des vorzeitigen Stratifikationsabbruchs bei
Mehlbeere (W = Wochen, VK = Vorkühlung) (Schneider und Šeho 2023).
Genetik und Anpassungsfähigkeit
Die Gattung Sorbus L. (Rosaceae) mit mehr als 250 Arten ist ein bekanntes Beispiel für eine komplexe Pflanzengruppe, die diploide, sexuell auskreuzende und selbstinkompatible Arten sowie eine große Anzahl polyploider Arten umfasst, die durch Hybridisierung, Allopolyploidie und Autopolyploidie entstanden sind (Sosa et al. 2014). Die komplizierten Verwandtschaftsverhältnisse innerhalb dieser Gattung haben zur Einführung vieler taxonomischer Ebenen geführt (Liesebach 2014). Bei verschiedenen Autoren existieren Untergattungen, Sektionen und verschiedene Aggregate, in denen eng verwandte Taxa zusammengefasst werden, sowie regionale Kleinarten (Liesebach et al. 2014). Mittels morphologischer und genetischer Methoden ist es möglich, kleinräumige Unterschiede bis hin zu einzelnen Individuen und Klonen festzustellen (Liesebach 2014). Darüber hinaus vermehren sich viele dieser Arten hauptsächlich ungeschlechtlich durch Apomixis, d. h. durch die Produktion von „mütterlichen" klonalen keimfähigen Samen (Robertson et al. 2010). Da apomiktische Pflanzen von einer Generation zur nächsten genetisch identisch sind, weist jede Linie einige der Merkmale einer echten Art auf und hält die Unterscheidung von anderen apomiktischen Linien innerhalb derselben Gattung aufrecht (Sosa et al. 2010). Aus Gründen des praktischen Naturschutzes, kann die Bezeichnung dieser Linien als taxonomische Einheit und damit als Schutzobjekt nützlich sein, gleichzeitig sollten neben existierenden lokalen Hybridformen auch die Ausgangsarten geschützt werden und damit der Prozess der andauernden Hybridisierung in Schutzkonzepte mit einbezogen werden (Liesebach 2014). Die Erhaltung der jeweiligen Formen ist lokal notwendig, schließt aber gleichzeitig eine Anpassung auf genetischer Ebene durch Neukombination der Erbanlagen aus und stellt damit eine evolutionäre Sackgasse dar (Liesebach 2014). Neueste Erkenntnisse weisen darauf hin, dass Apomikten ungerader Ploidie offenbar nicht immer vollständig genetisch isoliert sind und damit für die Evolution keine Rolle spielen (Meyer und Meierot 2021). Die triploiden Individuen ermöglichen ihnen, auf Veränderungen ihres Lebensraums zu reagieren und sexuellen Gen-Austausch mit Individuen anderer Ploidiestufen vorzunehmen. So entstandene Tetraploide sind prinzipiell in der Lage Meiose zu betreiben und über diploide Einzellen oder Pollen mit sich selbst oder anderen Sorbus-Sippen sexuell zu interagieren (Meyer und Meierot, 2021).
Zudem wird seit über zehn Jahren eine Neustrukturierung der Familie der Rosaceae diskutiert, wonach einige Sorbus-Arten darunter auch Mehlbeere und Elsbeere neue Gattungsnamen erhalten würden (Rohloff 2024). Diese Sicht hat sich aber bisher nicht durchgesetzt, da viele Botaniker dem skeptisch bis kritisch gegenüberstehen (Rohloff 2024).
Genom
Unter dem Begriff „Genom" versteht man die gesamte DNA-Menge eines Organismus. Darin enthalten sind alle wichtigen Informationen, die ein Baum zum Überleben benötigt. Im Zellkern ist die gesamte DNA in sog. Chromosomen organisiert. Bei der Mehlbeere können die Chromosomen in doppelter Ausführung (diploid) vorhanden sein, oder es kommen auch drei- (tri-) oder vierfache (tetraploide) Chromosomensätze vor. Das Genom der Sorbus-Arten ist bisher noch nicht vollständig sequenziert worden. Nächste Verwandte sind die Gattungen Malus und Crataegus mit bekannten Genomen. Diese haben eine Genomgröße von 658 Mb bzw. 628 Mb (NCBI). In diesem Bereich wird auch die Genomgröße für diploide Sorbus-Arten vermutet.
Nahverwandte Arten und Hybride
Neben der vielen endemischen Kleinst-Unterarten sind zahlreiche Hybridisierungen mit S. torminalis, S. aucuparia und S. chamaemespilus samt Rückkreuzungen bekannt (Meyer 2010). Chloroplastenanalysen von Sorbus-Arten in Großbritannien konnten die drei Arten S. aria, S. torminalis und S. aucuparia gut unterscheiden und zeigten, dass S. aria im Vergleich mit Proben aus Irland, Frankreich und Spanien zehn unterschiedliche Haplotypen besitzt, was einer hohen genetischen Vielfalt entspricht (Chester et al. 2007).
Zudem ist die Echte Mehlbeere (diploid) und ihre Kleinarten teilweise schwierig zu unterscheiden. Zum Beispiel ist eine tetraploide Kleinart „Berchtesgadener Mehlbeere" in den Chiemgauer Alpen und im angrenzenden Österreich beschrieben worden und möglicherweise durch Hybridisierung mit S. chamaemespilus entstanden (Meyer und Meierot 2021).
Beim Waldumbau und bei der Schutzwaldsanierung in den Alpen wird wegen ihrer Resilienz im Klimawandel verstärkt mit der Mehlbeere (S. aria s.str.) geplant. Damit auch das geeignete Vermehrungsgut eingesetzt werden kann, sind genetische Untersuchungen dringend notwendig. Mit Hilfe von genetischen Markern sollte die Mehlbeere (diploid) sowie die Kleinarten (mehrere Teilareale mit speziellen Formen) untersucht werden.
Anhand der Ergebnisse können konkrete Maßnahmen für die Erhaltung der Genressource sowie die nachhaltige Nutzung erarbeitet werden.
Genetische Diversität innerhalb der Mehlbeere
Populationsgenetische Studien, die die genetische Variation innerhalb der Mehlbeere untersuchen, sind bisher noch selten. Feulner et al. (2019) analysierten die Populationsstruktur der diploiden S. aria aus Mittel- und Südosteuropa. Die Ergebnisse haben gezeigt, dass die meisten tetraploiden Bäume in Mitteleuropa aus wiederkehrenden Kreuzungen von diploiden Bäumen mitteleuropäischen und südosteuropäischen Ursprungs hervorgegangen sind (Feulner et al. 2019).
In einer spanischen Studie konnte gezeigt werden, dass Mehlbeeren auf den Kanarischen Inseln triploid sind und eine geringere genetische Vielfalt aufweisen, als die Mehlbeeren auf dem spanischen Festland, welche di- und triploid waren (Sosa et al. 2014). Insgesamt war die genetische Vielfalt in den rein diploiden Populationen höher, was auf einen intensiveren Genfluss zwischen den Populationen hinweist. Vermutlich ist das auf die vorherrschende sexuelle Fortpflanzung zurückzuführen. Die triploiden Populationen wiesen dagegen eine geringere genetische Variabilität auf, was möglicherweise auf die ungeschlechtliche Fortpflanzung, hauptsächlich durch Apomixis, zurückzuführen ist. Die Fortpflanzungsbiologie und die Ploidie scheinen dabei für den Grad der genetischen Variabilität bei S. aria in Spanien verantwortlich zu sein (Sosa et al. 2014). Der Ursprung der Mehlbeere auf den Kanarischen Inseln könnte in Süd-Spanien oder Marokko liegen. Die genaue Zuordnung kann nur durch die gezielte genetische Analyse aller möglichen Ursprungspopulationen erfolgen.
Genetische Diversität der AWG-Samenplantagen „Mehlbeere, Vogelbeere und Elsbeere"
Aus den Blatt- bzw. Knospenproben der Mehlbeere, Elsbeere und Vogelbeere wurde die DNA nach einem leicht modifizierten Protokoll nach Doyle und Doyle 1995 (CTAB-Methode) extrahiert. Der DNA-Gehalt wurde stichprobenmäßig mit einem Photometer gemessen und die DNA auf ca. 20 ng/µl verdünnt. Im Anschluss wurde eine DNA-Analyse durchgeführt mittels hochvariabler Kern-Mikrosatelliten-Marker (nSSR-Marker). Die DNA wurde dafür in einer PCR-Reaktion mittels Qiagen-Multiplex-Kit und mit Fluoreszenzfarbstoffen markierten Primern vervielfältigt; die Auftrennung der vervielfältigten DNA-Fragmente erfolgte mittels vollautomatischer Kapillarelektrophorese (GeXP 8800, Beckman-Coulter).
Insgesamt wurden 14 nSSR-Marker, die für Sorbus aria und Malus-Arten entwickelt wurden, an allen drei Arten (Mehlbeere, Elsbeere und Vogelbeere) getestet. Es konnten bisher für die drei Arten nur vier gemeinsame Marker etabliert werden (CH01h01, MSS16, MSS13, CH02c09). Die folgenden Ergebnisse basieren daher zusätzlich auf einem artspezifischen Markerset: für Mehlbeere 11, für Elsbeere acht und für die Vogelbeere sieben Marker.
Für die Elsbeere wurden folgende acht Kern-Mikrosatelliten-Marker benutzt (MSS1, MSS5, MSS6, MSS9, MSS13, MSS16 (Oddou‐Muratorio et al. 2001), CH01h01 (Gianfranceschi et al. 1998), CH02c09 (Liebhard et al. 2002). Die Marker waren hochvariabel und zeigten zwischen 7 und 20 Allele.
Für die Mehlbeere wurden die Marker SA03, SA01, SA02, SA06, SA07, SA08 (González-González et al. 2010) neu am AWG etabliert. Zusätzlich wurden die acht Marker der Elsbeere getestet, davon war ein Marker monomorph (MSS1) und zwei haben nicht funktioniert (MSS6, MSS9). Insgesamt stehen nun 11 gut funktionierende Marker für die genetischen Analysen der Mehlbeere zur Verfügung. Diese waren sehr variabel mit 6 bis 25 Allelen.
Für die Vogelbeere wurden die Marker von Elsbeere und Mehlbeere getestet. Von den 14 getesteten Kern-Mikrosatelliten waren sieben erfolgreich (CH01h01, MSS16, MSS13, CH02c09, SA01, SA06, SA08). Bis auf einen Marker (MSS16 mit nur zwei Allelen) waren die Marker hochvariabel (zwischen 14 und 19 Allelen).
Die statistische Auswertung erfolgte mit den Softwareprogrammen Genalex (Peakall & Smouse 2012) und STRUCTURE, Version 2.3.4 (FALUSH et al., 2003), mit dem eine Clusteranalyse basierend auf einem Bayes’schen Ansatz durchgeführt wird.
Für die Plantage der Mehlbeere standen 86 Proben von 50 Genotypen für die genetische Analyse zur Verfügung. Anhand der Ergebnisse der genetischen Analyse konnten alle Bäume der diploiden Mehlbeere zugeordnet werden. Drei Bäume waren falsch beschriftet und konnten den richtigen Klonen zugeordnet werden. Acht Bäume konnten als Einzelgenotypen identifiziert werden. Die mittlere Anzahl der Allele als Maß für die genetische Vielfalt lag bei 11,6 und die effektive Anzahl der Allele als Maß für die genetische Diversität bei 6,3. Die beobachtete Heterozygotie (Gemischterbigkeit) lag bei 0,69 und die erwartete Heterozygotie bei 0,80, was zu einem leicht erhöhten Fixierungsindex führte (F = 0,13). Dieser könnte durch Null-Allele (fehlende Daten) bei zwei Genorten (SA08, SA03) zustande kommen.
Die Samenplantage der Vogelbeere besteht aus 38 Klonen mit 74 Bäumen. Aufgrund der genetischen Analyse konnten vier Bäume dem richtigen Klon zugeordnet werden. Sechs Bäume sind als Einzelgenotypen vorhanden. Nach der genetischen Analyse existieren noch 36 unterschiedliche Klone auf der Plantage. Die mittlere Anzahl der Allele betrug 15,3 und die effektive Anzahl der Allele lag bei 8,2. Die beobachtete Heterozygotie lag bei 0,69 und die erwartete Heterozygotie bei 0,80, was zu einem leicht erhöhten Fixierungsindex führt (F = 0,12). Dieser könnte durch Null-Allele bei zwei Genorten (CH01h01, SA06) zustande kommen.
Für die Samenplantage der Elsbeere in Neudorf wurden 93 Proben untersucht. Die Plantage ist aus Samen entstanden und enthält dennoch zwei idente Genotypen. Die mittlere Anzahl der Allele lag bei 13,9 und die Anzahl der effektiven Allele lag bei 6,3. Die beobachtete Heterozygotie lag bei 0,74 und die erwartete Heterozygotie bei 0,81, was zu einem niedrigen Fixierungsindex führt (F = 0,08). Dieser könnte durch Null-Allele bei einem Genort (CH02c09) zustande kommen.
Die genetische Vielfalt der einzelnen Plantagen unterscheidet sich trotz unterschiedlicher Marker nicht stark. Die Werte liegen durchwegs im mittleren bis hohen Bereich, was für das Saatgut eine hohe genetische Qualität bedeutet. Um diese nahen verwandten Baumarten direkt vergleichen zu können, bedarf es aber eines gemeinsamen Markersets mit mindestens 8 – 12 Genmarkern. Dazu bedarf es einer weitergehenden Forschung zur Markeroptimierung und Vergleich der Werte mit natürlichen Populationen.
Genetische Unterscheidung zwischen den Arten „Mehlbeere, Vogelbeere und Elsbeere"
Die gemeinsame Auswertung anhand der vier überlappenden Marker ergab eindeutige genetische Unterschiede zwischen den Arten. Der genetische Abstand nach Nei (1972) lag zwischen Mehlbeere und Vogelbeere bei 2,8, zwischen Mehlbeere und Elsbeere bei 2,9 und zwischen Vogelbeere und Elsbeere bei 1,9. Bei einer Annahme von zwei genetischen Clustern wird die Vogel- und Mehlbeere zu einem gemeinsamen Genpool zusammengefasst (oranger Genpool in Abbildung 3) und gegenüber der Elsbeere klar abgetrennt (blauer Genpool in Abbildung 3). Bei der Vogelbeere gibt es Hinweise auf die Hybridisierung mit der Elsbeere. Bei der Mehlbeere tritt bei zwei Individuen eine geringe Beimischung des Elsbeerengenpools auf. Bei einer Annahme von drei genetischen Clustern, erhält jede der drei untersuchten Baumarten einen eigenen Genpool (lila für die Mehlbeere, orange für die Vogelbeere und blau für die Elsbeere in Abbildung 4), wobei eine geringe Beimischung der Elsbeere bei der Vogelbeere und der Mehlbeere zu verzeichnen ist (Abbildung 4). Im ersten Schritt trennt sich die Elsbeere von der Vogel- und Mehlbeere ab, was zeigt, dass die beiden letzteren näher miteinander verwandt sind (Abbildung 3). Im zweiten Schritt der Analyse werden alle drei Arten sehr gut aufgetrennt und grenzen sich deutlich als eigenständige Arten mit gelegentlichen Hybridisierungen voneinander ab (Abbildung 4). Die Ergebnisse sollten aufgrund der geringen Markerzahl als vorläufig angesehen werden.
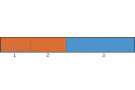
Abb. 3: Genetische Unterschiede zwischen den Samenplantagen der Vogelbeere (1), der Mehlbeere (2) und Elsbeere (3) bei Zugrundelegen von zwei genetischen Clustern. (© LWF)
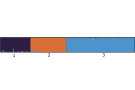
Abb. 4: Genetische Unterschiede zwischen den Samenplantagen der Vogelbeere (1), der Mehlbeere (2) und Elsbeere (3) bei Zugrundelegen von drei genetischen Clustern. (© LWF)
Erhaltung und Nutzung der Genressourcen
Zugelassene Erntebestände
Die Baumart Mehlbeere unterliegt nicht dem Forstvermehrungsgutgesetz (FoVG). Im Erntezulassungsregister (EZR) werden aktuell keine Erntebestände für Bayern gelistet. Für Thüringen führt das EZR einen Erntebestand der Sonderherkunft Sorbus latifolia im Staatswald Thüringen auf. Der Bestand 161 752 99 001 5 ist 0,3 Hektar groß, wurde 1896 begründet und 2006 zugelassen (EZR 2024). Die Bundesländer Bayern und Rheinland-Pfalz haben bereits Samenplantagen aufgebaut. Bei der Mehlbeere handelt es sich um eine typische Baumart für die Nutzung von Samenplantagen. Die Baumart ist meist in geringen Anteilen in Waldbestände beigemischt und Ernten in Hanglagen sind schwierig, ineffizient oder schlicht unmöglich. Auf einer Samenplantage werden ausgewählte Plusbäume zusammengeführt und als Reproduktionseinheit behandelt. So kann hochwertiges und genetisch vielfältiges Saatgut in großen Mengen und effizient durchführbaren Ernten produziert werden.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 5: Plusbaum der Mehlbeere auf der Samenplantage in Freilassing. (© M. Šeho)
Im Freistaat Bayern wird eine Samenplantage bei Freilassing durch das Bayerische Amt für Waldgenetik betrieben. Die Samenplantage wurde 1981 angelegt und im Jahr 2003 ergänzt und dient der Generhaltung und gleichzeitig der Produktion von hochwertigem Saatgut. Auf einer Fläche von 0,35 Hektar sind insgesamt 50 Genotypen mit 86 Bäumen vertreten. Die Plusbäume stammen aus den Bayerischen Alpen aus Höhenlagen über 900 Meter ü. NN. Es handelt sich hier um bewährte Vorkommen in den jeweiligen Wuchsgebieten. Bei der Plusbaumauswahl wurden damals 54 besonders vitale, wüchsige und geradschaftige Exemplare der Mehlbeere aus vorher gemeldeten Beständen ausgewählt. (Abbildung 5) Die ausgewählten Plusbäume wurden in den Wäldern bei Ruhpolding, Berchtesgaden, Bad Reichenhall, Siegsdorf, Rosenheim, Fischbachau, Bad Tölz und Oberammergau identifiziert und beschrieben. Anschließend wurden von den ausgewählten Plusbäumen Pfropfreiser aus dem oberen Kronenbereich gewonnen und auf Unterlagen, wie im Obstbau, veredelt. Mehrere Klone der Plusbäume wurden auf der Fläche maximal durchmischt gepflanzt, um die gegenseitige Bestäubung und den genetischen Austausch zu fördern. Die Samenplantage wird seit 1986 häufig beerntet und liefert so ihren Beitrag zu erstklassigem Saatgut für die Forstbranche (AWG unveröffentlicht). Seit 1986 konnten Mengen von 2 – 2,5 kg, ab 2001 bis 2006 von 27 bis 63 kg, 2020 sogar 249 kg Früchte geerntet werden.
Bedeutung / Rolle im Klimawandel
In den Leitlinien „Baumarten für den Klimawald" der Bayerischen Forstverwaltung wird die Mehlbeere zur Stärkung seltener heimischer Baumarten ausdrücklich genannt. Vorhandene Mehlbeeren sollten auf geeigneten Standorten und Nischen demnach durch Pflegemaßnahmen erhalten und gezielt gefördert werden, um die genetische Vielfalt von heimischen Haupt- und Nebenbaumarten zu stärken und zu erhöhen (StMELF 2020). Bei der Einbringung sollte möglichst umsichtig im Hinblick auf Lokalendemiten wie z. B. der Fränkischen Mehlbeere vorgegangen werden. Dazu ist derzeit ein Projekt der LFU zusammen mit dem AWG in Bearbeitung. Der Pionierbaumart kommt auf Grund ihrer Verbreitung durch Vögel, sowie ihrer Fähigkeit zur Bildung natürlicher Klone ohne sexuelle Prozesse eine wichtige Rolle in der Besiedlung konkurrenzarmer Gebiete und in Folge der durch die Klimaerwärmung bereits zusammenbrechenden Waldflächen eine wichtige Rolle zu (Meyer 2010, Fenner 2023). Auf Grund ihrer Fähigkeit längere Trockenperioden zu ertragen, ihrer Vorliebe für offene Standorte und ihrer ansprechenden Optik ist die Mehlbeere ein häufig gepflanzter Stadtbaum. Daher hat die bundesweite Gartenamtsleiterkonferenz (GALK) die Mehlbeere in die Liste der Zukunftsbäume für die Stadt aufgenommen (Fenner 2023).
Literatur
- Amann, G. (1954): Bäume und Sträucher des Waldes. 19. Auflage.
- AWG Bayerisches Amt für Waldgenetik (2023): Unveröffentlicht.
- Bayerisches Staatsministerium für Ernährung, Landwirtschaft und Forsten (2020): Baumarten für den Klimawald.
- Burkart, A. (2018): Kulturanleitung für Waldbäume und Wildsträucher. WSL Berichte. Heft 63, 2018.
- Chester, M.; Cowan, R.S.; Fay, M.F.; Rich, T.C. (2007): Parentage of endemic Sorbus L. (Rosaceae) species in the British Isles: evidence from plastid DNA. Botanical Journal of the Linnean Society, 154(3), 291-304.
- Erntezulassungsregister (EZR): Internetzugriff am 9.02.2024
- Fenner, Dr. R. (2023): Die Mehlbeere – Baum des Jahres 2024. Kuratorium Baum des Jahres.
- Gianfranceschi, L.; Seglias, N.; Tarchini, R.; Komjanc, M.; Gessler, C. (1998): Simple sequence repeats for the genetic analysis of apple. Theor Appl Genet 96(8):1069 -1076.
- González-González, E.A.; González-Pérez, M.A.; Rivero, E.; Sosa, P.A. (2010): Isolation and characterization of microsatellite loci in Sorbus aria (Rosaceae). Conservation Genetics Resources, 2, 341- 343.
- Liebhard, R.; Gianfranceschi, L.; Koller, B.; Ryder, C.D.; Tarchini, R.; Van de Weg, E.; Gessler, C. (2002): Development and characterisation of 140 new microsatellites in apple (Malus x domestica Borkh). Mol Breed 10(4):217-241. https://doi.org/10.1023/A:1020525906332
- Liesebach, H. (2014): Sexuelle und asexuelle Fortpflanzungsformen in der Gattung Sorbus L.(Rosaceae) – ein Review unter besonderer Berücksichtigung der Apomixis. Mitteilungen der Deutschen Dendrologischen Gesellschaft, 99, S. 55-66.
- Maier, J. (2014): Enzyklopädie der Holzgewächse. Sorbus III-2
- Meyer, N. (2010): Sorbus-Vielfalt in Bayern. LWF aktuell 79/2010. S. 45-48.
- Meyer, N.; Meierott, L. (2021): Ergänzende Beiträge zur Sorbus-Flora von Bayern, Bayerische Botanische Gesellschaft e.V.
- Namwar, K.; Spethmann, W. (1985): Die Baumarten der Gattung Sorbus: Vogelbeere, Mehlbeere, Elsbeere und Speierling. AFZ 36/1985.
- NCBI: https://www.ncbi.nlm.nih.gov/datasets/genome/GCA_028456015.1/ (Internetzugriff am 7.3.2024)
- Nei, M. (1972): Genetic distance between populations. Am Nat 106(949): 283-292. https://doi.org/10.1086/282771
- Oddou-Muratorio, S.; Aligon, C.; Decroocq, S.; Plomion, C.; Lamant, T.; Mush-Demesure, B. (2001): Microsatellite primers for Sorbus torminalis and related species. Mol Ecol Notes 1(4):297-299. https://doi.org/10.1046/j.1471-8278.2001.00116.x
- Peakall, R.; Smouse, P.E. (2012a): GenAlEx 6.5: genetic analysis in Excel. Population genetic software for teaching and research-an update. Bioinformatics 28: 2537–2539. https://doi.org/10.1111/j.1471-8286.2005.01155.x
- Robertson, A.; Rich, T.C.G.; Allen, A.M.; Houston, L.; Roberts, C.; Bridle, J.R.; Harris, S.A.; Hiscock, S.J. (2010): Hybrization and polyploidy as drivers of continuing evolution and speciation in Sorbus. Mol Ecol 19:1675 -1690.
- Rohloff, A. (2024): Die Echte Mehlbeere – Baum des Jahres 2024. AFZ-DerWald 4/2024.
- Verstl, A. (1997): Die europäischen Sorbus-Arten – Beerenstark und pflegeleicht. Deutsche Baumschule 5/1997.
- Schneider, M.; Šeho, M. (2023): Stratifikations- und Lagerungsversuch bei Mehlbeere. LWF aktuell 141, 31.
- Sosa, P.A.; González-González, E.A.; González-Pérez, M.A.; Naranjo-Cigala, A.; Carqué, E.; Acevedo, A. (2014): Reproductive strategy and ploidy determine the genetic variability of Sorbus aria. Tree genetics & genomes, 10, 679-688.
Weiterführende Informationen
Autor
- Barbara Fussi
- Daniel Glas
- Muhidin Šeho
 Zoombild vorhanden
Zoombild vorhanden
 Zoombild vorhanden
Zoombild vorhanden
 Zoombild vorhanden
Zoombild vorhanden





