
RSS-Feed der Bay. Landesanstalt für Wald und Forstwirtschaft abonnieren
So verpassen Sie keine Neuigkeiten mehr. Unser RSS-Feed "Nachrichten der Bayerischen Landesanstalt für Wald und Forstwirtschaft" informiert Sie kostenlos über unsere aktuellen Beiträge.
Stefan Müller-Kroehling
Die Flatterulme als Stadtbaum – LWF Wissen 83
Bäume gewinnen im Klimawandel zunehmend an Bedeutung im Kontext einer grünen Infrastruktur in der Stadt. Durch verschiedene Wirkungen sind Bäume in der Stadt der menschlichen Gesundheit sehr zuträglich, wenn sie
- Im Sommer Schatten spenden, UV-Licht filtern, die Temperatur senken, die Luftfeuchtigkeit erhöhen und Sauerstoff spenden
- Sicht-, Emissions- und Lärmschutz bieten
- Durch ihre grüne Farbe gesundheitsfördernd und beruhigend wirken (Stichwort »Waldbaden«)
Die landläufig von manchen Stadtbewohnern vertretenen Auffassungen, Bäume »machten Dreck« (gemeint ist das Abwerfen von Laub- und Samen) oder verursachten durch ihren Pollen Allergien, stellen eine einseitige Wahrnehmung dar. Tatsächlich verursachen nicht die Baumpollen Allergien, sondern zuvorderst die auf den Pollenkörnern abgelagerten Rußpartikel des anthropogenen Feinstaubs.
Es ist heute anerkannte Tatsache, dass die positiven Wirkungen von Bäumen für die menschliche Gesundheit in den Städten von sehr großer Bedeutung sind und im Klimawandel noch erheblich an Bedeutung gewinnen. Gleichzeitig werden durch den Klimawandel und Umweltverschmutzung aber Stadtbäume auch zunehmend Stressfaktoren wie Trockenheit, Hitze, schädliche UV-Strahlung, Ozon, aber auch Überschwemmungen durch zunehmende Starkregenereignisse ausgesetzt.
Hinzu kommt eine zunehmende Anzahl eingeschleppter Schädlinge, und ein aggressiveres Auftreten bereits vorhandener Schädlinge bei durch Witterungsextreme gestressten Bäumen.
Es ist heute anerkannte Tatsache, dass die positiven Wirkungen von Bäumen für die menschliche Gesundheit in den Städten von sehr großer Bedeutung sind und im Klimawandel noch erheblich an Bedeutung gewinnen. Gleichzeitig werden durch den Klimawandel und Umweltverschmutzung aber Stadtbäume auch zunehmend Stressfaktoren wie Trockenheit, Hitze, schädliche UV-Strahlung, Ozon, aber auch Überschwemmungen durch zunehmende Starkregenereignisse ausgesetzt.
Hinzu kommt eine zunehmende Anzahl eingeschleppter Schädlinge, und ein aggressiveres Auftreten bereits vorhandener Schädlinge bei durch Witterungsextreme gestressten Bäumen.
weiterlesen
Derzeit besteht eine Tendenz, bei den Untersuchungen, welche Bäume zukünftig in den Städten verwendet werden sollen, nichtheimische Arten zu favorisieren bzw. die Untersuchungen vor allem auf diese zu fokussieren. Dahinter steht vermutlich in vielen Fällen die Annahme, dass die seltenen heimischen Baumarten deswegen selten sind, weil sie so empfindlich und heikel sind, dass eine Pflanzung im Stadtklima daher von vorneherein ausscheidet. Diese Einstufung ist jedoch für die meisten der fraglichen Baumarten unzutreffend. Nicht wenige davon sind wie Elsbeere (Sorbus torminalis) und Flaumeiche (Quercus pubescens) wärmeliebend und könnten daher im Klimawandel weitere Klimabereiche für sich erschließen oder noch optimaler nutzen, was auch für die Flatterulme zutrifft (Thurm et al. in diesem Band).
Viele der »seltenen Arten« sind auch nur deswegen selten, weil ihre spezielle Verjüngungsbiologie (z. B. Rohbodenkeimer) ihre natürliche Vermehrung einschränkt, zusammen mit der Seltenheit von Samenbäumen. Hauptgrund ist jedoch oft die völlige Vernachlässigung ihrer Pflanzung in vielen Regionen, von der gelegentlichen Pflanzung von Einzelbäumen aus Artenschutzgründen abgesehen. Diese Zusammenhänge haben manche Baumarten, die früher sicher verbreiteter waren, regional aus dem Bewusstsein und aus der Landschaft verschwinden lassen. Eine solche Baumart ist die Flatterulme (Ulmus laevis) und soll hier, anknüpfend an Müller-Kroehling (2003b) und Müller-Kroehling und Kroehling (2016a und b) besprochen und als Stadtbaum »rehabilitiert« werden.
Viele der »seltenen Arten« sind auch nur deswegen selten, weil ihre spezielle Verjüngungsbiologie (z. B. Rohbodenkeimer) ihre natürliche Vermehrung einschränkt, zusammen mit der Seltenheit von Samenbäumen. Hauptgrund ist jedoch oft die völlige Vernachlässigung ihrer Pflanzung in vielen Regionen, von der gelegentlichen Pflanzung von Einzelbäumen aus Artenschutzgründen abgesehen. Diese Zusammenhänge haben manche Baumarten, die früher sicher verbreiteter waren, regional aus dem Bewusstsein und aus der Landschaft verschwinden lassen. Eine solche Baumart ist die Flatterulme (Ulmus laevis) und soll hier, anknüpfend an Müller-Kroehling (2003b) und Müller-Kroehling und Kroehling (2016a und b) besprochen und als Stadtbaum »rehabilitiert« werden.
Ulmen und Mensch
 Zoombild vorhanden
Zoombild vorhanden
Abb. 1: Schlangenartige Flatterulmenwurzel auf Gewerbefläche (Landshut) (Foto: S. Müller-Kroehling)
Ulmen weisen eine sehr lange Beziehung zum Siedlungsgebiet des Menschen auf, sowohl in der frühen Geschichte und Mythologie, als auch in der Landwirtschaft als Schneitelbaum (Richens 1983, Heybroeck 2013), sowie später in den verstädteren Gebieten als Parkbaum (Meyer 1982, Freytag von Loringhoven 1962). Diese jahrtausende alte tradierte Symbiose erlebte in den letzten einhundert Jahren einen gravierenden Einschnitt durch das eingeschleppte Ulmensterben, und man versuchte aufgrund der Bedeutung von Ulmen, vor allem auch als Landschafts- und Stadtbaum, diesem durch Resistenzzüchtung zu begegnen (z. B. Bilz 2006, Mackenthun 2015, Schwan et al. 2016). Dabei wurden zum Teil Kreuzungen heimischer Berg- und Feldulmen selektiert, vor allem aber auch Kreuzungsprodukte der europäischen bzw. amerikanischen mit resistenten asiatischen Ulmenarten durchgeführt. Zum Teil wurden auch asiatische Ulmenarten wie die Sibirische Ulme (Ulmus pumila) als Ersatz in den Städten angebaut (Osterloh 2010).
Insgesamt werden in Publikationen, die sich dem Schutz der Ulmen annehmen, sehr stark die Resistenzzüchtung als Lösung favorisiert (Bilz 2006, u. v. a.) und dabei heimische Ulmenarten und insbesondere die Flatterulme zu Unrecht vernachlässigt (Möller 1983). Es hat aber durchaus auch an Stimmen nicht gefehlt, die auch und bevorzugt den Erhalt der heimischen Ulmenarten als wichtig und erfolgversprechend herausgestellt haben (Brötje und Fellenberg 1994).
Gegen die Pflanzung resistenter Baumzüchtungen oder von exotischen Ulmen sprechen mehrere Gründe.
Insgesamt werden in Publikationen, die sich dem Schutz der Ulmen annehmen, sehr stark die Resistenzzüchtung als Lösung favorisiert (Bilz 2006, u. v. a.) und dabei heimische Ulmenarten und insbesondere die Flatterulme zu Unrecht vernachlässigt (Möller 1983). Es hat aber durchaus auch an Stimmen nicht gefehlt, die auch und bevorzugt den Erhalt der heimischen Ulmenarten als wichtig und erfolgversprechend herausgestellt haben (Brötje und Fellenberg 1994).
Gegen die Pflanzung resistenter Baumzüchtungen oder von exotischen Ulmen sprechen mehrere Gründe.
weiterlesen
Zum einen können die Klone oder Exoten verwildern, d. h. sich beginnen, in heimische Habitat auszuwildern, oder mit heimischen Arten zu kreuzen, und können dabei auch invasiv werden (Cogolludo-Agustin et al. 2000, Osterloh 2010, Brunet et al. 2013). Die potenziellen Auswirkungen auf heimische Ökosysteme, und auf heimische Arten, können vorher nicht abgeschätzt werden.
Zweitens können die Klone sich als hochgradig anfällig für andere, eingeschleppte Schädlinge erweisen, im Falle der Ulmen etwa für die Ulmen-Phloemnekrose (Braun und Sinclair 1978, Sinclair et a. 2001, Katanic et al. 2016) oder den Ulmen-Blattkäfer (Stipes und Camapana 1981).
Ferner können sich die Resistenzzüchtungen zu einem späteren Zeitpunkt als doch anfällig für das Ulmensterben erweisen, etwa, wenn eine andere Unterart des Ulmensterbens in ein Gebiet kommt, oder wegen altersbedingter Veränderungen, oder durch Infektion in Form von Wurzelverwachsungen (Weiß 2018, Roloff 2019).
Auch können heimische Arten, die auf Ulmen leben, nur teilweise diese Klone als Habitat nutzen (Braune 2007, Müller-Kroehling 2019, in diesem Band, Beitrag zur Biodiversität).
Zweitens können die Klone sich als hochgradig anfällig für andere, eingeschleppte Schädlinge erweisen, im Falle der Ulmen etwa für die Ulmen-Phloemnekrose (Braun und Sinclair 1978, Sinclair et a. 2001, Katanic et al. 2016) oder den Ulmen-Blattkäfer (Stipes und Camapana 1981).
Ferner können sich die Resistenzzüchtungen zu einem späteren Zeitpunkt als doch anfällig für das Ulmensterben erweisen, etwa, wenn eine andere Unterart des Ulmensterbens in ein Gebiet kommt, oder wegen altersbedingter Veränderungen, oder durch Infektion in Form von Wurzelverwachsungen (Weiß 2018, Roloff 2019).
Auch können heimische Arten, die auf Ulmen leben, nur teilweise diese Klone als Habitat nutzen (Braune 2007, Müller-Kroehling 2019, in diesem Band, Beitrag zur Biodiversität).
Alle diese Gründe lassen es ratsam erscheinen, mit Resistenzzüchtungen von Ulmen zurückhaltend umzugehen. Allgemein könnte man empfehlen:
- Keine Resistenzzüchtungen im Wald und der freien Landschaft auszubringen
- Exotische Arten grundsätzlich zuerst in Versuchsanbauten darauf hin zu testen, ob sie eine Tendenz haben, sich invasiv auszubreiten
- Stets heimische Alternativen zu bevorzugen, die eine viel breitere genetische Basis haben und dadurch anderen Streßfaktoren und Schädlingen besser widerstehen können.
Flatterulmen in bayerischen Städten
 Zoombild vorhanden
Zoombild vorhanden
Abb. 2: Markanter Einzelbaum beim Pfarrheim der Nikola-Kirche in Landshut Foto: (S. Müller-Kroehling)
In zahlreichen bayerischen Städten wie Ingolstadt, Landsberg und Augsburg, Weilheim, München (auf dem Viktualienmarkt und im Englischen Garten) oder Erlangen (Schmutterer 1951) stehen Flatterulmen im Stadtgebiet und haben sich als Straßenbaum offenbar gut bewährt.
Nicht allen Städten sind oder waren ihre Flatterulmen-Vorkommen auch als solche bekannt bzw. wurden als solche dokumentiert. Schmutterer (1951) berichtete beispielsweise von einem starken Auftreten des Ulmenblattflohs an »zahlreichen Straßenulmen « in Erlangen, ohne diese bis zur Art bestimmt zu haben, und es muss sich angesichts der Bindung dieser Tierart an die Flatterulme zweifelsfrei um Flatterulmen handeln.
Auch in zahlreichen Städten anderer Bundesländer wie in Berlin, Eberswalde, Zwickau und wahrscheinlich vielen weiteren stehen Flatterulmen, eine systematischen oder gar vollständigen Überblick gibt es bedauerlicher Weise (ebenso wenig wie für wenigstens für die Arboreten in Deutschland) nicht.
Nicht allen Städten sind oder waren ihre Flatterulmen-Vorkommen auch als solche bekannt bzw. wurden als solche dokumentiert. Schmutterer (1951) berichtete beispielsweise von einem starken Auftreten des Ulmenblattflohs an »zahlreichen Straßenulmen « in Erlangen, ohne diese bis zur Art bestimmt zu haben, und es muss sich angesichts der Bindung dieser Tierart an die Flatterulme zweifelsfrei um Flatterulmen handeln.
Auch in zahlreichen Städten anderer Bundesländer wie in Berlin, Eberswalde, Zwickau und wahrscheinlich vielen weiteren stehen Flatterulmen, eine systematischen oder gar vollständigen Überblick gibt es bedauerlicher Weise (ebenso wenig wie für wenigstens für die Arboreten in Deutschland) nicht.
weiterlesen
Beispielsweise in Landshut, Langenbach, Pfarrkirchen und selbst in Zwiesel im Inneren Bayerischen Wald stehen markante Flatterulmen an den jeweiligen Hauptbahnhöfen. Gut erforscht ist der Bestand am Landshuter Hauptbahnhof (Müller-Kroehling und Kroehling 2015) und besteht aus Altbäumen und zum Teil auch Naturverjüngung auf Ruderalstellen mit Rohboden. Auch ein ca. 6 Hektar großes, seit etwa einem halben Jahrhundert weitgehend sich selbst überlassenes Areal, der Landshuter »Bahnhofswald«, weist eine Population der Flatterulme mit Exemplaren unterschiedlichen Alters auf.
In den Weichholzaue-artigen Beständen stellt sie einige mächtige Altbäume, die sich ohne jede Förderung durchgesetzt haben. Ein Teil der in der Nähe der Gleise stehenden Bäume wird regelmäßig auf den Stock gesetzt und hat daher den Charakter von Ausschlaggehölzen, was sie ebenfalls sehr gut verträgt (vgl. sogar die Verwendung in Kurzumtriebsplantagen, Devetakovic et al. 2018).
Das Vorkommen der Art an Bahnhöfen ist vermutlich kein reiner Zufall, weniger wegen des Transportes der Samen mit der Bahn, sondern wegen des Vorhandenseins von Rohboden- und Störstellen, die vergleichbar den Flussauen günstige Keimbedigungen bieten. Aber natürlich ist durchaus auch von der Existenz früherer Pflanzungen auszugehen. Andererseits ist das Vorhandsein gepflanzter Flatterulmen kein Beweis dafür, dass ein Flatterulmenvorkommen als Ganzes nicht ursprünglich ist, wie das Beispiel Landshut zeigt. Hier gehörte die Flatterulme der Flora der nahen Isaraue bereits ursprünglich an, was unter anderem daran zu erkennen ist, dass sie vielfach gerade in jenen Waldbeständen zu finden ist, die durch das Vorhandensein von Lavendelweide (Salix eleagnos) und Echter Schwarzpappel (Populus nigra) gekennzeichnet sind und mithin von Baumarten, die (ebenfalls) in der Vergangenheit praktisch nie gepflanzt wurden.
Aus solchen Auenvorkommen heraus konnte sie sich auf brachgefallenen Standorten von Industriegleisen und vergleichbaren Bedingungen ansamen, während ihre diese Möglichkeit auf vielen anderen Flächen als Rohbodenkeimerin verwehrt bliebt. Hatte sie sich dort angesamt, wurden die Jungbäume sicher auch das eine oder andere Mal auf geeignete, andere Standorte umgesetzt, wo man sie wachsen lassen konnte. So entstanden gleichsam »halbnatürliche« Vorkommen.
In den Weichholzaue-artigen Beständen stellt sie einige mächtige Altbäume, die sich ohne jede Förderung durchgesetzt haben. Ein Teil der in der Nähe der Gleise stehenden Bäume wird regelmäßig auf den Stock gesetzt und hat daher den Charakter von Ausschlaggehölzen, was sie ebenfalls sehr gut verträgt (vgl. sogar die Verwendung in Kurzumtriebsplantagen, Devetakovic et al. 2018).
Das Vorkommen der Art an Bahnhöfen ist vermutlich kein reiner Zufall, weniger wegen des Transportes der Samen mit der Bahn, sondern wegen des Vorhandenseins von Rohboden- und Störstellen, die vergleichbar den Flussauen günstige Keimbedigungen bieten. Aber natürlich ist durchaus auch von der Existenz früherer Pflanzungen auszugehen. Andererseits ist das Vorhandsein gepflanzter Flatterulmen kein Beweis dafür, dass ein Flatterulmenvorkommen als Ganzes nicht ursprünglich ist, wie das Beispiel Landshut zeigt. Hier gehörte die Flatterulme der Flora der nahen Isaraue bereits ursprünglich an, was unter anderem daran zu erkennen ist, dass sie vielfach gerade in jenen Waldbeständen zu finden ist, die durch das Vorhandensein von Lavendelweide (Salix eleagnos) und Echter Schwarzpappel (Populus nigra) gekennzeichnet sind und mithin von Baumarten, die (ebenfalls) in der Vergangenheit praktisch nie gepflanzt wurden.
Aus solchen Auenvorkommen heraus konnte sie sich auf brachgefallenen Standorten von Industriegleisen und vergleichbaren Bedingungen ansamen, während ihre diese Möglichkeit auf vielen anderen Flächen als Rohbodenkeimerin verwehrt bliebt. Hatte sie sich dort angesamt, wurden die Jungbäume sicher auch das eine oder andere Mal auf geeignete, andere Standorte umgesetzt, wo man sie wachsen lassen konnte. So entstanden gleichsam »halbnatürliche« Vorkommen.
Das Beispiel Landshut
 Zoombild vorhanden
Zoombild vorhanden
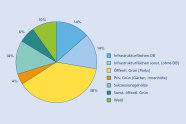
Abb. 3: Flatterulmen nach Nutzungstypen des Vorkommens im Stadtgebiet von Landshut (Grafik: LWF)
Müller-Kroehling und Kroehling (2016a, 2016b) haben basierend auf einer Bestandserhebung durch Kroehling (2015) im Stadtgebiet von Landshut exemplarisch aufgezeigt, dass die Flatterulme hier eine halbnatürliche Population aufweist, die sowohl dem Ulmensterben getrotzt hat, als auch sich selbst erhält, und belegt durch Reliktvorkommen in den umgebenden Isarauen, als natürliches Vorkommen zu deuten ist.
Die Landshuter Population (Abbildung 3) verteilt sich auf sehr verschieden Situationen wie innerstädtische Vorkommen und solche im Wald und besteht zu erheblichen Anteilen (grüne und blaue Signaturen in der Abbildung, zusammen 58 %) auf Vorkommen, von den von einer spontanten Entstehung durch Naturverjüngung auszugehen ist.
Mackenthun (2007) fand die Flatterulme zum Vergleich im Bereich des Hamburger Elbhanges praktisch nur in der freien Landschaft und ganz vereinzelt in privaten Gärten.
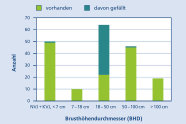
Das Durchmesser- bzw. Altersverhältnis (Abbildung 4) in Landshut spiegelt wider, dass die Flatterulme in Landshut alt wird und eine sich selbst erhaltene Population aufweist. Von Abgängen in Folge von Bauaktivität oder aufgrund von Verkehrssicherung abgesehen sind Ausfälle praktisch unbekannt.
In der höchsten Altersklasse treten durchaus Holzfäulen und damit in Verbindung stehende Fällungen aus Verkehrssicherungsgründen auf, sind aber mit in den 1980er Jahren in die Stämme eingeschraubten Installationen wie Laternen in Verbindung zu bringen. Neuerdings werden bei solchen Verkehrssicherungsmaßnahmen Kappungen statt Fällungen bevorzugt, und die Flatterulme treibt bei solchen Maßnahmen offenbar in der Regel gut wieder aus.
Die Landshuter Population (Abbildung 3) verteilt sich auf sehr verschieden Situationen wie innerstädtische Vorkommen und solche im Wald und besteht zu erheblichen Anteilen (grüne und blaue Signaturen in der Abbildung, zusammen 58 %) auf Vorkommen, von den von einer spontanten Entstehung durch Naturverjüngung auszugehen ist.
Mackenthun (2007) fand die Flatterulme zum Vergleich im Bereich des Hamburger Elbhanges praktisch nur in der freien Landschaft und ganz vereinzelt in privaten Gärten.
Das Durchmesser- bzw. Altersverhältnis (Abbildung 4) in Landshut spiegelt wider, dass die Flatterulme in Landshut alt wird und eine sich selbst erhaltene Population aufweist. Von Abgängen in Folge von Bauaktivität oder aufgrund von Verkehrssicherung abgesehen sind Ausfälle praktisch unbekannt.
In der höchsten Altersklasse treten durchaus Holzfäulen und damit in Verbindung stehende Fällungen aus Verkehrssicherungsgründen auf, sind aber mit in den 1980er Jahren in die Stämme eingeschraubten Installationen wie Laternen in Verbindung zu bringen. Neuerdings werden bei solchen Verkehrssicherungsmaßnahmen Kappungen statt Fällungen bevorzugt, und die Flatterulme treibt bei solchen Maßnahmen offenbar in der Regel gut wieder aus.
weiterlesen
Auch Mackenthun (2007) fand in den von ihm untersuchten Teilen Hamburgs die Flatterulme über die Altersklassen verteilt, und die stärksten Ulmen des Gebietes stellend. Naturverjüngung der Art stellt er kaum fest. Er vermutet, dass in den zwei Wellen des Ulmensterbens, die Hamburg erlebte, zahlreiche Ulmen abstarben.
In München hat die Flatterulme einen als autochthon einzustufenden Bestand und kommt hier innerstädtisch u. a. im Bereich der Isar-Seitenbäche und an der Isar im stark verstädterten Bereich vor. Auch wenn eine Bestandsaufnahme fehlt, stellt sie hier (oft wohl als Art unerkannt) vielfach die markantesten Altbäume und die einzigen alten Ulmen.
Sogar auf dem Viktualienmarkt ist sie mit markanten Einzelbäumen vertreten (vgl. auch Foto in Müller-Kroehling 2003b). Speziell im Englischen Garten kommen alle drei heimischen Ulmenarten vor, und offenbar fielen in den 1980er Jahren mehrere tausend davon dem Ulmensterben zum Opfer. Palten (in v. Freyberg, S. 230) schreibt leider nur von »der Baumart Ulme«.
Aufgrund der Unkenntnis eines natürlichen und vitalen Vorkommens der Flatterulme und ihrer Resistenz gegen das Ulmensterben wurden bedauerlicher Weise in den 1980er und 1990er Jahren offenbar nur Resistenzzüchtungen und exotische Ulmenarten gepflanzt.
In München hat die Flatterulme einen als autochthon einzustufenden Bestand und kommt hier innerstädtisch u. a. im Bereich der Isar-Seitenbäche und an der Isar im stark verstädterten Bereich vor. Auch wenn eine Bestandsaufnahme fehlt, stellt sie hier (oft wohl als Art unerkannt) vielfach die markantesten Altbäume und die einzigen alten Ulmen.
Sogar auf dem Viktualienmarkt ist sie mit markanten Einzelbäumen vertreten (vgl. auch Foto in Müller-Kroehling 2003b). Speziell im Englischen Garten kommen alle drei heimischen Ulmenarten vor, und offenbar fielen in den 1980er Jahren mehrere tausend davon dem Ulmensterben zum Opfer. Palten (in v. Freyberg, S. 230) schreibt leider nur von »der Baumart Ulme«.
Aufgrund der Unkenntnis eines natürlichen und vitalen Vorkommens der Flatterulme und ihrer Resistenz gegen das Ulmensterben wurden bedauerlicher Weise in den 1980er und 1990er Jahren offenbar nur Resistenzzüchtungen und exotische Ulmenarten gepflanzt.
Flatterulmen und die GALK-Stadtbaumliste
 Zoombild vorhanden
Zoombild vorhanden
Abb. 4: Durchmesserstufen als Altersnäherung im Stadtgebiet von Landshut (Grafik: LWF)
Für Stadtbäume gibt es eine Empfehlungsliste der Stadtgartenamtleiterkonferenz (GALK), zuletzt aufgestellt 2012 und abgestimmt mit dem »Bund deutscher Baumschulen« (BDB) (GALK 2012). Die Flatterulme wird seit 1983 nicht mehr in dieser Liste geführt (Bilz 2006), wegen ihrer mutmaßlichen Empfindlichkeit gegenüber dem Ulmensterben.
Diese Einstufung basiert indes auf Infektionsversuchen, die nicht den natürlichen Bedingungen entsprechen. Die Versuchsbäume sind nur wenige Jahre alte Jungbäume und können daher mehrere der möglichen Resistenzmechanismen wie eine Abschottung überhaupt nicht durchführen. Auch übersieht eine Betrachtung auf Basis künstlicher Infektion von Jungbäumen, dass die konkreten Arten möglicherweise von den Überträgern gar nicht oder deutlich weniger angeflogen werden, was speziell von der Flatterulme und den Hauptüberträgern bekannt ist.
Ferner ist auch relevant, dass im Freiland auch ein anderes Zusammenspiel mit dem Besiedlungskomplex des Ulmensterbens aus Kleinpilzen, Nematoden, Milben und Bakterien bestehen kann (vgl. Müller-Kroehling in diesem Band), von dem durchaus angenommen wird, dass es einen Einfluss auf die Pathogenität des Ulmensterbens hat (Moser et al. 2010). Auch die Sporenfracht natürlicher im Gegensatz zu künstlichen Infektionsquellen hat eine erhebliche Auswirkung auf den Infektionserfolg, der bei künstlichen Infektionen viel höher ist (Faccoli 2001).
Die Flatterulme ist gegen das Ulmensterben nicht nur auf besseren Auwaldstandorten (Bilz 2006) und auch nicht nur in Form bestimmter Herkünfte (Bilz 2006) wenig empfindlich, sondern allgemein, wofür es eine sehr breite Palette von Beobachtungen aus ganz Europa gibt, auch aus Städten (vgl. Müller-Kroehling in diesem Band, Beitrag zum Waldschutz). Nicht umsonst hat die Art in Städten überlebt, in denen praktisch alle Exemplare der anderen beiden heimischen Ulmenarten abgestorben sind, und dies ohne etwa den Einsatz von Insektiziden oder Fungizidinjektionen.
Alle sieben in der GALK-Liste aufgeführten Bewertungskriterien sind von der Flatterulme bestens erfüllt (vgl. Tabelle 1).
Da der eigentlich sehr bedeutsame Faktor des ästhetischen Wertes in den Kriterien nicht explizit enthalten ist, wurde er hier unter dem letzten Kriterium »Verwendungsmöglichkeiten für besondere Fälle« mit angeführt.
Diese Einstufung basiert indes auf Infektionsversuchen, die nicht den natürlichen Bedingungen entsprechen. Die Versuchsbäume sind nur wenige Jahre alte Jungbäume und können daher mehrere der möglichen Resistenzmechanismen wie eine Abschottung überhaupt nicht durchführen. Auch übersieht eine Betrachtung auf Basis künstlicher Infektion von Jungbäumen, dass die konkreten Arten möglicherweise von den Überträgern gar nicht oder deutlich weniger angeflogen werden, was speziell von der Flatterulme und den Hauptüberträgern bekannt ist.
Ferner ist auch relevant, dass im Freiland auch ein anderes Zusammenspiel mit dem Besiedlungskomplex des Ulmensterbens aus Kleinpilzen, Nematoden, Milben und Bakterien bestehen kann (vgl. Müller-Kroehling in diesem Band), von dem durchaus angenommen wird, dass es einen Einfluss auf die Pathogenität des Ulmensterbens hat (Moser et al. 2010). Auch die Sporenfracht natürlicher im Gegensatz zu künstlichen Infektionsquellen hat eine erhebliche Auswirkung auf den Infektionserfolg, der bei künstlichen Infektionen viel höher ist (Faccoli 2001).
Die Flatterulme ist gegen das Ulmensterben nicht nur auf besseren Auwaldstandorten (Bilz 2006) und auch nicht nur in Form bestimmter Herkünfte (Bilz 2006) wenig empfindlich, sondern allgemein, wofür es eine sehr breite Palette von Beobachtungen aus ganz Europa gibt, auch aus Städten (vgl. Müller-Kroehling in diesem Band, Beitrag zum Waldschutz). Nicht umsonst hat die Art in Städten überlebt, in denen praktisch alle Exemplare der anderen beiden heimischen Ulmenarten abgestorben sind, und dies ohne etwa den Einsatz von Insektiziden oder Fungizidinjektionen.
Alle sieben in der GALK-Liste aufgeführten Bewertungskriterien sind von der Flatterulme bestens erfüllt (vgl. Tabelle 1).
Da der eigentlich sehr bedeutsame Faktor des ästhetischen Wertes in den Kriterien nicht explizit enthalten ist, wurde er hier unter dem letzten Kriterium »Verwendungsmöglichkeiten für besondere Fälle« mit angeführt.
Tabelle 1: GALK-Kriterien für die Stadtbaumbeurteilung (nach GALK 2012) und Einstufung sowie Literaturbelege durch den Verfasser
| Kriterium laut GALK 2012 | Bewertung Flatterulme durch Verfasser |
|---|---|
| Morphologische und physiologische Eigenschaften (Wuchskraft, Kronen-, Stammund Wurzelbildung, Habitus, Lichtdurchlässigkeit u. a.) | Wuchskraft in der Jugend hoch, im Alter nachlassend, bis 35 (40 m), standfest (Brettwurzeln), Krone relativ unregelmäßig, aber kompakt, Lichtdurchlässigkeit mittel; neigt zu Brettwurzeln und dem Austrieb schlafender Augen; entgegen mancher Literaturfundstellen keine Neigung zu Wurzelbrut (Kienitz 1882) |
| Standortsansprüche (Klima, Boden, Wasser, Lichtbedarf) | Deutlich weniger anspruchsvoll an den Nährstoffhaushalt als die anderen beiden heimischen Ulmenarten, auch auf Sand und (An)moor, zähe Böden und hoch anstehendes Grundwasser, Trockenheit und Überschwemmungen vertragend (Kiermeier 1988, Köstler et al. 1968); Lichtbedarf und -durchlässigkeit mittel (Blattflächenindex 5,4 Jaro 1959 in Leuschner und Ellenberg 2017) |
| Gärtnerischer Aufwand Verbesserung der Wachstumsbedingungen, Pflegeaufwand) | Sehr gering/keine erforderlich; anders als etwa die Sibirische Ulme (Osterloh 2010) neigt die Flatterulme nicht etwas zu Zweigverlusten und Zweigabbrüchen nach Stürmen, sondern verfügt im Gegenteil über ein ausgesprochen zähes Holz (Müller-Kroehling 2005); Verträglichkeit gegenüber Schnittmaßnahmen sehr gut (Devetakovic et al. 2018; eig. Beobachtungen) |
| Erfahrungen über Lebenserwartung, Widerstandsfähigkeit gegen Umweltbelastungen aller Art, extreme Wachstumsverhältnisse | Tolerant gegen Steppenbedingungen (Viktorov und Bystrjancev 1960) und Salzstandorte (Viktorov und Bystrjancev 1960), wenig empfindlich gegenüber Trockenheit (Köstler et al. 1968, Müller-Kroehling und Kroehling 2016) und Emissionsbelastung (Möller 1983); Lebenserwartung entgegen der Literatur nicht nur bis 250, sondern bis über 400 Jahre (Ullrich et al. 2009); neigt wie alle Ulmen gelegentlich zu bakteriellem Schleimfluss, der jedoch pilzhemmend wirkt (Stipes und Campana 1981) und insofern kein Problem für die Standsicherheit darstellt |
| Verkehrssicherheit | Neigt nicht zu brüchigem Holz, sondern hat im Gegenteil ein ausgesprochen zähes Holz (Müller-Kroehling 2005), ferner auch durch die Brettwurzeln zusätzlich standfest |
| Regionale Besonderheiten und Erfahrungen | Auch in höheren Lagen ca. um 800 m vital und ohne nennenswerte Frostschäden (Müller-Kroehling und Clauss 2011) |
| Verwendungsmöglichkeiten für besondere Fälle | Überflutungsgeneigte Standorte; hohes Maß an Ästhetik durch die Brettwurzeln, Maserknollen, kanariengelbes Herbstlaub, elegante asymmetrische Blattform mit starker Zähnung, elegante Blüten und Früchtstände; Wichtige Bienentracht u. a. durch den Blattfloh (Schmutterer 1951) |
Uralte Flatterulmen als Naturdenkmäler und Alleebäume
Eine der zahlreichen falschen Informationen über die Flatterulme, die in der forstlichen wie auch der populären Literatur noch vor 20 Jahren überwogen, war ihre geringe Größe als vermeintlicher »Baum zweiter Ordnung« und ihr geringes Maximalalter, das höchsten mit ca. 200 oder 250 Jahren angegeben wurde (vgl. kritisch Müller-Kroehling 2003b). Korrekt ist, wie heute allgemein bekannt, dass die Flatterulme bis 40 Meter (und höher) werden kann und Alter von über 500 Jahren erreichen kann (Ullrich et al. 2009).
Ullrich et al. (2009) haben in ihrem Buch der 500 ältesten Bäume 21 uralte Ulmen in Deutschland dokumentiert, so dass gute 4,2 % dieser alten Bäume Ulmen sind. Auch wenn für drei Exemplare die Artzugehörigkeit nicht angegeben ist, sind darunter zweifelsfrei insgesamt mindestens 19 Flatterulmen (90 % der Ulmen in der Zusammenstellung und 3,8 % der Altbäume insgesamt). Es ist mithin sehr auffällig, dass sich unter den uralten Ulmen Deutschlands praktisch ausschließlich Flatterulmen finden.
Dies dürfte mit sehr hoher Wahrscheinlichkeit mit der Anfälligkeit der beiden anderen heimischen Arten gegenüber dem Ulmensterben zusammenhängen. In dem Buch sind überwiegend Flatterulmen in ländlichen Siedlungen oder in der Kulturlandschaft abgebildet, während der Erhalt uralter Bäume mit ihren zahlreichen potenziellen Baumdefekten und sich daraus ergebendenen Problematiken im städtischen Bereich offenbar nicht im selben Maße gelingt. Flatterulmen mit 100 bis 200 Jahren Alter sind aber durchaus auch im städtischen Bereich möglich, wie das Beispiel Landshut zeigt (Müller-Kroehling und Kroehling 2015).
Auch als Alleebaum ist die Flatterulme geeignet, auch wenn Ulmenalleen zumindest heute, d. h. nach über 100 Jahren Ulmensterben, eine Seltenheit darstellen. Schulz (2006) erwähnte nur eine Allee mit Ulmen in Form einer alten Misch-Allee mit Stieleichen, Eschen, Spitzahornen und Flatterulmen in Brandenburg, und in diesem Kontext erwähnenswert ist sicher auch das T-förmige Ensemble des Parks der Ringelstecherwiese in Landshut mit seinen aktuell 52 Altbäumen (Müller- Kroehling und Kroehling 2015). Auch aus Hamburg sind Ulmen-Alleen bekannt geworden (Freytag von Loringhoven 1962), einer Stadt, die sich besonders um den Schutz ihrer Ulmen bemüht (Mackenthun 2007).
Ullrich et al. (2009) haben in ihrem Buch der 500 ältesten Bäume 21 uralte Ulmen in Deutschland dokumentiert, so dass gute 4,2 % dieser alten Bäume Ulmen sind. Auch wenn für drei Exemplare die Artzugehörigkeit nicht angegeben ist, sind darunter zweifelsfrei insgesamt mindestens 19 Flatterulmen (90 % der Ulmen in der Zusammenstellung und 3,8 % der Altbäume insgesamt). Es ist mithin sehr auffällig, dass sich unter den uralten Ulmen Deutschlands praktisch ausschließlich Flatterulmen finden.
Dies dürfte mit sehr hoher Wahrscheinlichkeit mit der Anfälligkeit der beiden anderen heimischen Arten gegenüber dem Ulmensterben zusammenhängen. In dem Buch sind überwiegend Flatterulmen in ländlichen Siedlungen oder in der Kulturlandschaft abgebildet, während der Erhalt uralter Bäume mit ihren zahlreichen potenziellen Baumdefekten und sich daraus ergebendenen Problematiken im städtischen Bereich offenbar nicht im selben Maße gelingt. Flatterulmen mit 100 bis 200 Jahren Alter sind aber durchaus auch im städtischen Bereich möglich, wie das Beispiel Landshut zeigt (Müller-Kroehling und Kroehling 2015).
Auch als Alleebaum ist die Flatterulme geeignet, auch wenn Ulmenalleen zumindest heute, d. h. nach über 100 Jahren Ulmensterben, eine Seltenheit darstellen. Schulz (2006) erwähnte nur eine Allee mit Ulmen in Form einer alten Misch-Allee mit Stieleichen, Eschen, Spitzahornen und Flatterulmen in Brandenburg, und in diesem Kontext erwähnenswert ist sicher auch das T-förmige Ensemble des Parks der Ringelstecherwiese in Landshut mit seinen aktuell 52 Altbäumen (Müller- Kroehling und Kroehling 2015). Auch aus Hamburg sind Ulmen-Alleen bekannt geworden (Freytag von Loringhoven 1962), einer Stadt, die sich besonders um den Schutz ihrer Ulmen bemüht (Mackenthun 2007).
Abiotische und biotische Stressfaktoren
Da dieser Faktor im Klimawandel besonders in den Fokus rücken muss, sollten Stressfaktoren des urbanen Raumes hier noch einmal konkret betrachtet werden. Bäume unterliegen in Städten einer zusätzlichen Zahl von Stressfaktoren, wie großer Hitze und Trockenheit, Bodenverdichtung, Streusalzen, Hundeurin und ähnlichem mehr (Meyer 1982). Tabelle 2 fasst die bekannten Wirkungen biotischer und abiotischer Schadfaktoren auf die Flatterulme zusammen.
Brände können im Laufe eines Baumlebens u. a. dann auftreten, wenn es zu Ortsbränden kommt, aber auch durch Brandstiftung an Parkbäumen durch Kinder und Jugendliche, die immer wieder auftritt. Mehrere der sehr alten Flatterulmen Deutschlands haben Brände überstanden (Ullrich et al. 2009).
Bereits Möller (1993) hat darauf hingewiesen, dass die Flatterulme »sogar in stark immissionsbelasteten« Standorten Berlins »prächtige Exemplare« aufwies. In Serbien wird ihre Anbaumöglichkeit in schwermetallbelasteten Gebieten erwähnt (Kadovic und Knezevic in Devetakovic et al. 2016).
Die Flatterulme weist zusammenfassend sehr viele Eigenschaften auf, die sie als exzellenten Stadtbaum charakterisieren, und kein Merkmal, dass in nennenswertem Umfang gegen ihre Verwendung spricht. Da einzige Grund, die Flatterulme nicht auf der GALK-Liste zu führen, basiert auf nicht auf das Freiland übertragbaren Infektionsversuchen und ist nicht valide.
Beispielsweise in Serbien wird die Flatterulme als geeigneter Stadtbaum eingestuft (Devetakovic et al. 2016), obwohl das Ulmensterben auf der Balkanhalbinsel weit verbreitet ist.
Es wäre es an der Zeit, die GALK-Einstufung zu korrigieren, zumal sie ja der Realität in deutschen Städten nicht entspricht. Es darf angenommen werden, dass eine solche Änderung auch nicht etwa eine Konkurrenzsituation mit den derzeit empfohlenen Resistenzzüchtungen sortengeschützter Ulmen ergäbe, da diese ja zum Teil völlig andere Eigenschaften als die Flatterulme aufweisen, v. a. eine überwiegend deutlich geringere Wüchsigkeit.
Brände können im Laufe eines Baumlebens u. a. dann auftreten, wenn es zu Ortsbränden kommt, aber auch durch Brandstiftung an Parkbäumen durch Kinder und Jugendliche, die immer wieder auftritt. Mehrere der sehr alten Flatterulmen Deutschlands haben Brände überstanden (Ullrich et al. 2009).
Bereits Möller (1993) hat darauf hingewiesen, dass die Flatterulme »sogar in stark immissionsbelasteten« Standorten Berlins »prächtige Exemplare« aufwies. In Serbien wird ihre Anbaumöglichkeit in schwermetallbelasteten Gebieten erwähnt (Kadovic und Knezevic in Devetakovic et al. 2016).
Die Flatterulme weist zusammenfassend sehr viele Eigenschaften auf, die sie als exzellenten Stadtbaum charakterisieren, und kein Merkmal, dass in nennenswertem Umfang gegen ihre Verwendung spricht. Da einzige Grund, die Flatterulme nicht auf der GALK-Liste zu führen, basiert auf nicht auf das Freiland übertragbaren Infektionsversuchen und ist nicht valide.
Beispielsweise in Serbien wird die Flatterulme als geeigneter Stadtbaum eingestuft (Devetakovic et al. 2016), obwohl das Ulmensterben auf der Balkanhalbinsel weit verbreitet ist.
Es wäre es an der Zeit, die GALK-Einstufung zu korrigieren, zumal sie ja der Realität in deutschen Städten nicht entspricht. Es darf angenommen werden, dass eine solche Änderung auch nicht etwa eine Konkurrenzsituation mit den derzeit empfohlenen Resistenzzüchtungen sortengeschützter Ulmen ergäbe, da diese ja zum Teil völlig andere Eigenschaften als die Flatterulme aufweisen, v. a. eine überwiegend deutlich geringere Wüchsigkeit.
Ausblick – Ulmenerhaltung 2.0.
Zahlreiche Versuche sind unternommen worden, die Ulmen in den Städten zu erhalten, allerdings mit zum Teil ganz unterschiedlichen Ansätzen, vom Einsatz von Insektiziden oder Fungiziden in Form von Impfungen der Bäume, oder in Form des Brutraum-Entzug durch Entfernen erkrankter Baumteile und Bäume (»Sanitation«), oder aber vor allem auch der Nachpflanzung mutmaßlich resistenter Ulmen-Züchtungen oder asiatischer Ulmenarten. Aus den verschiedenen Forschungsprogrammen können folgende Grundsätze zusammengefasst werden:
- Es gilt, die heimischen Ulmen zu erhalten, wo sie vorkommen, und dies ist bei konzeptionellen und konsequenten Vorgehen auch möglich und leistbar.
- Für gegen das Ulmensterben empfindliche heimische Arten gilt, dass »Sanitation« als pestizidfreie Methode bewährt und vor allem in Städten, aber auch in überschaubaren Waldbeständen bzw. bei gut kartierten und bekannten Ulmenvorkommen praxiserprobt und praktikabel ist.
- Flatterulmen sind wenig anfällig für Krankheiten einschließlich des Ulmensterbens und in jeder Hinsicht sehr geeignete Stadtbäume und sollten in Städten weiterhin und verstärkt Berücksichtigung finden
- Gleichzeitig können auch exotische Ulmen und Resistenzzüchtungen eine wertvolle Ergänzung städtischer Ulmenbestände sein. Sie sollten aber heimische Ulmen nicht verdrängen, und Resistenzzüchtungen heimischer Arten sollte der Vorrgegeben werden; dies gilt in besonderem Maß in naturnahen Lebensräumen wie Wäldern und naturnahen Parks.
- Zurückhaltung wegen exotische Bäüme ist unter anderem wegen der bestehenden Gefahr der Verwildung bzw. des Invasiv-Werdens, sowie der ungelenkten Einkreuzung in heimische Arten geboten.
- Große Rein- und Dominanzbestände sollten bei allen Baumarten vermieden werden, da jede Baumart Schädlinge und Schäden kennt und durch die Folgen der Globalisierung laufend neue Schädlinge selbst zu jenen Baumarten gebracht werden, die heute noch wenig anfällig für Schädlinge und Krankheiten erscheinen.
- Eine breite Artenvielfalt und breite genetische Basis und Mischungen sind, wie in den Wäldern, die besten Garanten für gesunde Baumbestände in den Städten.
Dieser Beitrag rehabilitiert die Flatterulme als Stadtbaum und zeigt Möglichkeiten für konsequenten Ulmenschutz auf. Bereits Möller (1983) kritisierte damals die Empfehlungen, keine Ulmen zu pflanzen, als zu undifferenziert, und bemängelte, dass bei den stattdessen empfohlenen Baumarten ein zu starkes Gewicht auf fremdländische Gehölze gelegt werde.
Diese Entwicklung hat sich fortgesetzt, und bedarf spätestens im »Jahr der Flatterulme« einer Kurskorrektur. Mehr als 120 heimische Arten sind weitgehend auf Ulmen angewiesen (Müller-Kroehling, in diesem Band), und die Flatterulme ein sehr wichtiges »Rettungsfloß« für die meisten dieser Arten (Möller 1983). Flatterulmen sind in jeder Hinsicht wunderbare Stadtbäume mit einer sehr langen Tradition und sollten in den Städten der Zukunft, in denen wir eher mehr als weniger Bäume brauchen, verstärkt wieder einen Platz haben.
Diese Entwicklung hat sich fortgesetzt, und bedarf spätestens im »Jahr der Flatterulme« einer Kurskorrektur. Mehr als 120 heimische Arten sind weitgehend auf Ulmen angewiesen (Müller-Kroehling, in diesem Band), und die Flatterulme ein sehr wichtiges »Rettungsfloß« für die meisten dieser Arten (Möller 1983). Flatterulmen sind in jeder Hinsicht wunderbare Stadtbäume mit einer sehr langen Tradition und sollten in den Städten der Zukunft, in denen wir eher mehr als weniger Bäume brauchen, verstärkt wieder einen Platz haben.
Zusammenfassung
Die als eher wärmebedürftig eingestufte Flatterulme hat auch eine günstige Prognose im Klimawandel. Umso mehr überrascht es, dass ihr auf der entsprechenden Liste der »Stadtgartenamtsleiterkonferenz« keine Eignung als Stadtbaum bescheinigt wird, zumal diese Einstufung gleich sechs Tatsachen entgegensteht:
ihrer weiteren Verbreitung in zahlreichen deutschen Städten, ihren günstigen Holzeigenschaften (extrem »zähes« Holz, das nicht zum Brechen neigt), ihrem erfolgreichen Anbau sogar als Windschutzgehölz in den Steppen Osteuropas, ihrer Unempfindlichkeit gegenüber Stadtklima, sowie gegenüber Schädlingen, sowie nicht zuletzt auch ihrer Attraktivität durch die markanten Brettwurzeln, eleganten Blätter und Fruchtstände und die kanariengelbe Herbstfärbung.
Das relevante Gegenargument, ihre mutmaßliche Empfindlichkeit gegenüber dem Ulmensterben, basiert auf Resistenzversuchen mit Jungpflanzen, die nicht den Verhältnissen in der Natur entsprechen.
ihrer weiteren Verbreitung in zahlreichen deutschen Städten, ihren günstigen Holzeigenschaften (extrem »zähes« Holz, das nicht zum Brechen neigt), ihrem erfolgreichen Anbau sogar als Windschutzgehölz in den Steppen Osteuropas, ihrer Unempfindlichkeit gegenüber Stadtklima, sowie gegenüber Schädlingen, sowie nicht zuletzt auch ihrer Attraktivität durch die markanten Brettwurzeln, eleganten Blätter und Fruchtstände und die kanariengelbe Herbstfärbung.
Das relevante Gegenargument, ihre mutmaßliche Empfindlichkeit gegenüber dem Ulmensterben, basiert auf Resistenzversuchen mit Jungpflanzen, die nicht den Verhältnissen in der Natur entsprechen.
Literatur
- Arnold, V.; Dörfler, W. (2013): Pollen-, Holzkohle- und Geländeanalysen aus dem schleswig-holsteinischen Riesewohld, Kreis Dithmarschen. Offa (Berichte und Mitteilungen zur Urgeschichte, Frühgeschichte und Mittelalterarchäologie) 69/70: 53-70.
- Bilz, D. (2006): Ulme als Straßenbaum. – Baumzeitung, 03/06: 29-31.
- Braun, E.J.; Sinclair, W.A. (1979): Phloem necrosis of elms: symptoms and histopathological observations in tolerant hosts. – Phytophathology 69(4): 354-358.
- Brötje, H.; Fellenberg, U. (1993): Erste Erfahrungen mit der Ulmenerhaltung in Norddeutschland. – Ber. Hess. FVA 16: 39-43.
- Brunet, J.; Zalapa, J.E.; Pecori, F.; Santini, A. (2013): Hybridization and introgression between the exotic Siberian elm, Ulmus pumila, and the native Field elm, U. minor, in Italy. – Biological Invasions 15(12): 2717-2730.
- Buhr, H. (1965): Bestimmungstabellen der Gallen (Zoo- und Phytocecidien) an Pflanzen Mittel- und Nordeuropas. Bd. II. – Jena, 1572 S. + Tafeln.
- Cogolludo-Agustin, M.A.; Agundez, D.; Gil, L. (2000): Identification of native and hybrid elms in Spain using isoyme gene markers. – Heredity 85: 157-166.
- Devetakovic, J.; Stanković, D.; Ivetic, V.; Sijacic-Nikolic; M.; Maksimović, Z. (2016): Potential of different European White Elm (Ulmus laevis Pall.) genotypes for phytoextraction of heavy metals. – Fresenius Environmental Bulletin 25. 4318-4323.
- Devetakovic, J.; Todorovic, N.; Vilotic, D.; Ivetic, V. (2018): European white elm (Ulmus laevis Pall.) biomass production in high-density plantation. – Reforesta 2018: 22-26.
- Faccoli, M. (2001): Elm bark beetles and Dutch Elm Disease: tests of combined control. – Anz. Schädlingskde./J. Pest Science 74: 22-29.
- Freyberg, P. v. (2000, Bearb.): Der Englische Garten in München. – München, 303 S.
- Freytag von Loringhoven, F. (1962): Bäume in der großen Stadt – Alte Bäume in Hamburg. – Hamburg, 78 S.
- GALK (2012): GALK-Straßenbaumliste (Hrsg. Deutsche Gartenamtsleiterkonferenz, GALK), abfrage vom 4.6.2019, mit Vorbemerkungen zur GALK-Straßenbaumliste 2012, Beurteilung von Baumarten für die Verwendung im städtischen Straßenraum (Stand 2/2012), 3 S.
- Heeschen, G.; Wälter, T. (2012): Urwaldstandorte in Schleswig- Holstein. – Natur und Landschaft 87(11): 489-495.
- Heybroek, H.M: (2013): The elm, tree of milk and wine. – iForest – Biogeosciences and Forestry 8: 181-186 (Collection: 3rd International Elm Conference, Florence (Italy - 2013) »The elms after 100 years of Dutch Elm disease« Guest Editors: A. Santini, L. Ghelardini, E. Collin, A. Solla, J. Brunet, M. Faccoli, A. Scala, S. De Vries, J. Buiteveld).
- Ivanov, A.F. (1984): Protection forests in the Kulunda steppe. – Lesnoe-Khozyaistvo 9: 41-43.
- Janssen, G.; Hewicker, H-A. (2006): Die Flatterulme (Ulmus laevis Pall.) in Schleswig-Holstein. Verbreitung, Habitat und Vergesellschaftung, Gefährdung und Schutz. – Drosera, Naturkdl. Mitt. Nordwestdeutschland 2006: 47-66.
- Janssen, G.; Hewicker, H.-A. (2007): Ein gehäuftes Vorkommen der Flatterulme (Ulmus laevis Pall.) in Südholstein. – Natur- u. Landeskde. 114: 5-25.
- Katanic, Z.; Krstin, L.; Jezic, M.; Zebec, M.; Curkovic-Perica, M. (2016): Molecular characterization of elm yellows phytoplasmas in Croatia and their impact on Ulmus spp. – Plant Pathology 65(9): 1430-1440.
- Kienitz, M. (1882): Die in Deutschland wild wachsenden Ulmenarten. – Z. Forst- u. Jagdw. 24: 37-51.
- Kiermeier, P. (1988): Bund Deutscher Baumschulen (BDB) – Handbuch Wildgehölze (2. Aufl.). – Pinneberg, 231 S.
- Köstler, J.N.; Brückner, E.; Bibelriether, H. (1968): Die Wurzeln der Waldbäume. – Hamburg und Berlin, 284 S.
- Kreutzer, K. (1987): Die standörtlichen Verhältnisse im Auwald – Schriftenr. Bayer. Forstverein 7: 64-79.
- Kroehling, A.; Müller-Kroehling, S. (2013): Die Flatterulme (Ulmus laevis PALL.) im Stadtgebiet von Landshut (Niederbayern). – Naturw. Z. fr. Niederbayern 34: 99-124.
- Leuschner, C.; Ellenberg, H. (2017): Ecology of Central European Forests. Vegetation Ecology of Central Europe, Vol. I. – Cham/ Schweiz (Springer), 971 S.
- Li, M.; Lopez, R.; Venturas, M.; Pita, P.; Gordaliza, G.G.; Gil, L.; Rodriguez-Clcerrada, J. (2015): Greater resistance to flooding of seedlings of Ulmus laevis than Ulmus minor is related to the maintenance of a more positive carbon balance. – Trees 29: 835-848.
- Mackenthun, G. (2007): Ergebnisse der Ulmen-Kartierung am Hamburger Elbhang. – Ber. Bot. Ver. Hamburg 23: 3-25.
- Mackenthun, G. (2015): Eine Zukunft für Ulmen. Die Ergebnisse des großen Ulmen-Resistenztest in den Niederlanden 20017 bis 2012. Teil 1: Methoden und Ergebnisse. ProBaum, 4/2015: S. 18-21.
- Maes, B. (2013): Inhemse bomen en struiken in Nederland en Vlaanderen. – Utrecht, 428 S.
- Meyer, F.H. (1982): Bäume in der Stadt (2., ergä. Aufl.). – Stuttgart, 380 S.
- Mittempergher, L., Fagnani, A.; Ferrini, F. (1993): L’olmo ciliato (Ulmus laevis Pallas), un olmo europeo interessante e poco conosciuto. – Monti e Boschi 44(4): 13-17.
- Möller, G. (1993): Ulmenerhaltung aus der Sicht des Naturschutzes – Probleme und Möglichkeiten. – Ber. Hess. FVA 16: 68-86.
- Moser, J.C.; Konrad, H.; Blomquist, S.R.; Kirsits, T. (2010): Do mites phoretic on elm bark beetles contribute to the transmission of Dutch elm disease? – Naturwissenschaften 97: 219-227.
- Müller-Kroehling, S. (2003a): Ulmus laevis PALL. – Flatterulme. – In Weisgerber, H. et al. (Hrsg.): Enzyklopädie der Holzgewächse (33. Ergänzungslieferung).
- Müller-Kroehling, S. (2003b): Flatterulme – ein unbekannter Baum. Zehn verbreitete Irrtümer zu einer heimischen Baumart. – AFZ/Der Wald 25: 1282-1286.
- Müller-Kroehling, S. (2003c): Die Flatterulme in Bayern. – LWF aktuell 42: 51-54.
- Müller-Kroehling, S. (2005): Flatterrüster (Ulmus laevis PALL.) – eine wenig bekannte heimische Holzart. – Holz-Zentralblatt 131(8): 109-111.
- Müller-Kroehling, S. (2011): Eschentriebsterben, Erlen-Phytophtora: Die Flatterulme als Alternative und Ersatz in geschädigten Feuchtwaldbeständen. – AFZ/Der Wald 19: 36-38.
- Müller-Kroehling, S.; Clauss, V. (2011): Alternative zu Esche und Schwarzerle – ein Plädoyer für die Flatterulme. – Forstinfo 6: 4.
- Müller-Kroehling, S.; Kroehling, A. (2016a): Beobachtungen zur Flatterulme als Stadtbaum: Plädoyer für die Flatterulme. – Deutsche Baumschule 4/2016: 34.
- Müller-Kroehling, S.; Kroehling, A. (2016b): Die Flatterulme als Stadtbaum in Landshut (Niederbayern). Bemerkungen zum Vorkommen, Vitalität und Eignung der Flatterulme im urbanen Raum. – Jahrbuch der Baumpflege 2016: 290-296.
- Osterloh, D. (2010): Erfahrungsbericht aus Fürth: Sibirische Ulme als Straßen- und Parkbaum. – AFZ/Der Wald 8: 15-16.
- Petercord, R. (2017): Im Zickzack durch das Ulmenblatt. – AFZ/ Der Wald 8:30-31.
- Richens, R.H. (1983): Elm. – Cambridge, 347 S.
- Röhrig, E. (1996): Die Ulmen in Europa. Ökologie und epidemische Erkrankung. – Forstarchiv 67: 179-198.
- Roloff, A. (2019): Baum des Jahres 2019: die Flatter-Ulme (Ulmus laevis) – Ihr Charakter: Eigenschaften und Besonderheiten. – Jahrbuch der Baumpflege 23: 13-19.
- Schmutterer, H. (1951): Der Ulmenblattfloh Psylla ulmi Frst. (Homoptera: Psylloidea) als Honigtauerzeuger und Beiträge zu seiner Lebensweise. – Zeitschr. Bienenforschung 1(6): 99- 102.
- Schulz, Olaf, (2006): Die schönsten Alleen in Deutschland: Eine Bildreise von der Ostsee bis zum Alpenvorland. – München, 160 S.
- Schwan, J.; Lösing, H.; Scheewe, P. (2016): Die Gattung Ulmus als Baum der Zukunft unter Berücksichtigung der Holländischen Ulmenkrankheit. – Mitt. DDG 101: 127-134.
- Sinclair, W.A.; Townsend, A.M.; Sherald, J.L. (2001): Elm Yellows Phytoplasma lethal to Dutch Elm Disease-resistant Ulmus americana cultivars. – Plant Disease 85(5):560.
- Stipes, R.J.; Campana, R.J. (1981): Compendium of Elm Diseases. – St. Paul, Minnesota, 92 S.
- Ullrich, B.; Kühn, U.; Kühn, S. (2009): Unser 500 ältesten Bäume. – München, 318 S.
- Venturas, M.; Fernández, V.; Nadal, P.; Guzmán, P.; Lucena, J.J.; Gil, L. (2014): Root iron uptake efficiency of Ulmus laevis and U.minor and their distribution in soils of the Iberian Peninsula. – Frontiers of Plant Science 5, article 104, 1-9.
- Viktorov, D.P.; Bystrjancev, N.I. (1960): Pvysenie zasuhoustojcivosti sejancev berezy i vjaza pod vlijaniem fosfornyh udobrenij (Increasing the drought resistance of Birch and Elm seedlings with P fertilizers). – Lesn. Z., Arhangel’sk 3(3): 35-40 (aus Forestry Abstracts).
- Vyskot, M. (1984): Vliv vodohospodarskych uprav na vyvoj tloust’koveho prirustu drevin luzniho lesa (Effect of water-management practices on the diameter increment of floodplain forest tree species). – Lescnictvi 30(9): 737-765 (aus Forestry Abstracts).
- Weiß, H. (2018): Ulmen und ihre Risiken in der Stadt (Teil 1 und 2) – AFZ/Der Wald 16: 44-48 und 20: 36-39.


