MIMIC®-Einsatz: Auswirkungen auf Bienen - LWF aktuell 135
 Zoombild vorhanden
Zoombild vorhanden
Abb. 1: Bienenstand mit Versuchsvölkern (© I. Illies, LWG)
In den Jahren 2018 bis 2020 gab es in Franken eine Schwammspinner-Massenvermehrung, die auf Teilfächen einen Pflanzenschutzmitteleinsatz notwendig machte. Dabei wurde das im konventionellen Gemüse-, Obst- und Weinbau verbreitete Pflanzenschutzmittel MIMIC® eingesetzt. MIMIC® ist als nicht bienengefährlich eingestuft. Trotzdem gab es Bedenken aus der Imkerschaft, dass Bienen mit dem Wirkstoff in Kontakt und zu Schaden kommen. In einem Praxisversuch wurde überpüft, ob Vorsichtsmaßnahmen dies verhindern können. Nachfolgend werden die Versuchsergebnisse aus dem Jahr 2020 vorgestellt.
Eichenwälder zeichnen sich durch eine große Artenvielfalt aus, darunter auch zahlreiche gefährdete Arten und Eichenspezialisten. Doch einzelne Arten können empfindliche Schäden verursachen. Eine Gruppe von Schmetterlingsarten wird unter dem Begriff »Eichenfraßgesellschaft« zusammengefasst. Diese Arten sind zum Aufbau von Massenvermehrungen befähigt – ihre Raupen können Eichen- und Eichen-Mischwälder durch flächigen Kahlfraß massiv schädigen. Hierzu gehören Eichenwickler (Tortrix viridana), Frostspannerarten (Erannis defoliaria, Operophtera brumata und weitere), Frühlingseulen (Orthosia spec.) und der Schwammspinner (Lymantria dispar).
Schwammspinner: bedeutendste Art der Eichenfraßgesellschaft
Die Raupen entwickeln sich noch im Herbst in den Eiern und überwintern in den Gelegen. Sie schlüpfen Ende April und beginnen mit ihrer Fraßtätigkeit bereits an den aufbrechenden Knospen. Die Fraßzeit des Schwammspinners ist deutlich länger als die der anderen Mitglieder der Eichenfraßgesellschaft. Die Raupen fressen von Laubausbruch (Ende April/Anfang Mai) bis Ende Juni, so dass nicht nur der Maitrieb, sondern auch Ersatztriebe und Johannistrieb betroffen sein können. Dadurch werden die Bäume massiv geschwächt und anfällig für Folgeschädlinge. Eine besondere Eigenschaft der Jungraupen ist, dass sie unmittelbar nach dem Schlüpfen Seidenfäden spinnen, mit deren Hilfe sie sich vom Wind verfrachten lassen. So verteilen sie sich über ganze Waldbestände und auch über weitere Strecken in neue Fraßgebiete.
Pflanzenschutzmitteleinsatz in gefährdeten Eichenbeständen
Im Jahr 2020 ermittelte die Abteilung »Waldschutz« der Bayerischen Landesanstalt für Wald und Forstwirtschaft (LWF) eine Kahlfraßgefährdungsfläche von knapp 7.300 ha. In mehreren Prüfschritten wurden anschließend Flächen wieder aus der Behandlungskulisse herausgenommen, z. B. Waldflächen, für die betroffene Waldeigentümer keine Anmeldung zum Einsatz von PSM eingereicht hatten. Mit 2.782 ha wurde letztendlich eine deutlich geringere Fläche mit dem Pflanzenschutzmittel MIMIC® als die ursprünglich ermittelte Gefährdungsfläche behandelt (vgl. Hahn et al. 2021).
Für die Pflanzenschutzmittelbehandlung wählte das Waldschutz-Team der LWF MIMIC® mit dem Wirkstoff Tebufenozid aus, weil es unter den zur Verfügung stehenden PSM-Präparaten ihrer Einschätzung nach das beste Verhältnis von Wirksamkeit, Wirkungsdauer und geringen Nebenwirkungen auf Nichtzielorganismen aufwies. Tebufenozid wirkt als Häutungsbeschleuniger selektiv auf Schmetterlingslarven (Smaaghe et al. 1995). Es bewirkt einen Fraßstopp, eine Beschleunigung der Häutungen und nach fünf bis sieben Tagen das Absterben der Raupen. Die Ausbringung von MIMIC® auf den ausgewählten rund 2.780 ha erfolgte mittels Hubschrauber (750 ml/ha in 50 l/ ha Wasser) im Mai 2020.
MIMIC® ist als bienenungefährlich eingestuft (Bienengefährdungsstufe B4) und gilt als nicht schädigend für Raubmilben, Marienkäfer, Laufkäfer, Spinnen und Schlupfwespen. Imkerinnen und Imker befürchteten dennoch, dass Bienen mit dem Wirkstoff in Kontakt kommen und dass es auch zu Rückständen in den Bienenprodukten kommen könnte.
Monitoring zu Auswirkungen auf Bienen
In Retzstadt (Unterfranken) wurden im Behandlungsgebiet und an einem Kontrollstandort Versuchsgruppen mit jeweils sechs Bienenvölkern aufgestellt:
- Gruppe I: Kontrolle, Standort außerhalb des Behandlungsgebietes
- Gruppe II: Versuchsstandort im Behandlungsgebiet mit offenem Flugloch am Tag der Behandlung
- Gruppe III: Versuchsstandort im Behandlungsgebiet mit geschlossenem Flugloch am Tag der Behandlung
Vor der Applikation wurden aus allen Bienenvölkern Futterproben entnommen und Pollenproben mittels Pollenfallen gewonnen. Pollenfallen sind Vorrichtungen mit runden Gitteröffnungen am Flugloch, die Bienen passieren müssen, um in den Stock zu gelangen. Pollensammlerinnen verlieren dabei ihre Pollenhöschen, die dann aufgefangen werden. Die Pollenfallen der Gruppe I und II wurden am Tag der Applikation geleert – die der Gruppe III nicht, da diese am Versuchstag verschlossen war. Am Folgetag wurden bei allen Gruppen Pollen entnommen. Zusätzlich fing man an den Völkern vor, am Tag der Applikation und am Folgetag heimkehrende Sammlerinnen ab. Diese Tiere und die Pollenproben wurden auf Rückstände von Tebufenozid untersucht. Die Erfassung der Mortalität der Bienenvölker erfolgte täglich über Totenfallen am Flugloch (Illies et al. 2002) (Abbildung 1).
Versuchsergebnisse
Bei Völkern mit Flugmöglichkeit am Behandlungstag konnten Rückstände des Wirkstoffs in heimkehrenden Sammlerinnen und im Pollen nachgewiesen werden (Abbildung 3 und 4). Am Behandlungstag betrugen diese in den Sammlerinnen rund 184 µg/kg, im Pollen bis zu 23.600 µg/kg. Am Folgetag nahmen diese Rückstände in den Sammlerinnen (knapp 37 µg/kg) und im Pollen ab, wobei im Pollen mit 6.189 µg/kg im Maximum immer noch eine erhebliche Wirkstoffmenge feststellbar war. Auch bei den Bienenvölkern, die am Behandlungstag verschlossen waren, fanden sich am Folgetag Rückstände in Sammlerinnen (knapp 14 µg/kg) und im Pollen (407–1.232 µg/kg). Im Honig, der im Anschluss an den Versuch von den Bienenvölkern geerntet wurde, konnte der Wirkstoff nicht nachgewiesen werden.
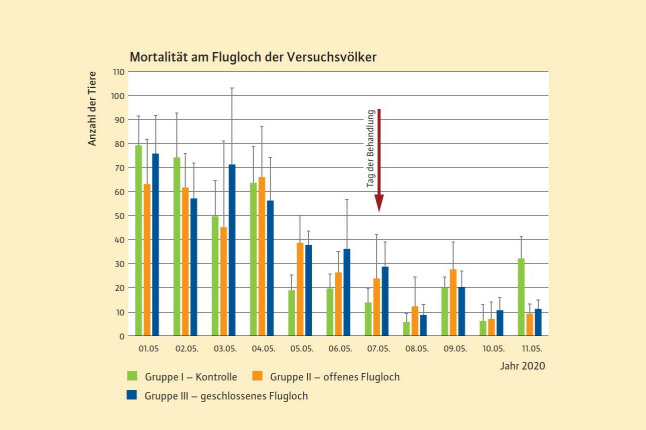
Abb. 2: Dargestellt ist die Anzahl toter Tiere (Mittelwerte ± Standardabweichung) in den Fallen im Zeitraum vom 01.05.11.05.2020 (n je Gruppe = 6). Der Pfeil markiert den Behandlungstag, an dem der Wirkstoff Tebufenozid ausgebracht wurde. (© LWF)
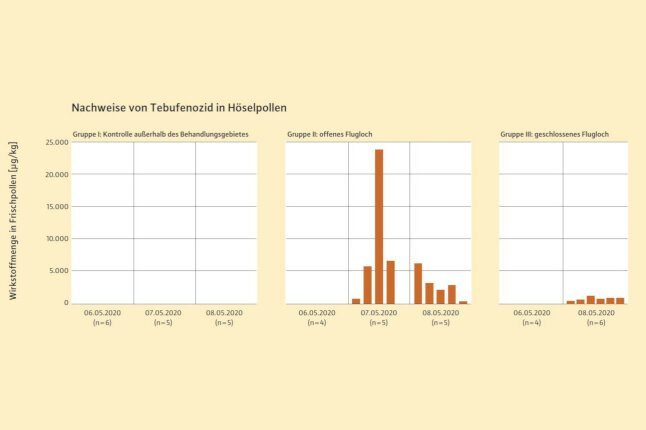
Abb. 3: Der Pollen wurde am Tag vor der Behandlung (06.05.), am Tag der Behandlung (07.05.) und am Folgetag (08.05.) mittels Pollenfallen gesammelt. Dargestellt sind die Wirkstoffmengen in den einzelnen Proben. War die Pollenmenge für eine Analyse zu gering, wurden Proben gepoolt, daher sind die Stichproben z. T. kleiner 6. LOQ ( Bestimmungsgrenze) = 10 µg/kg. (© LWF)
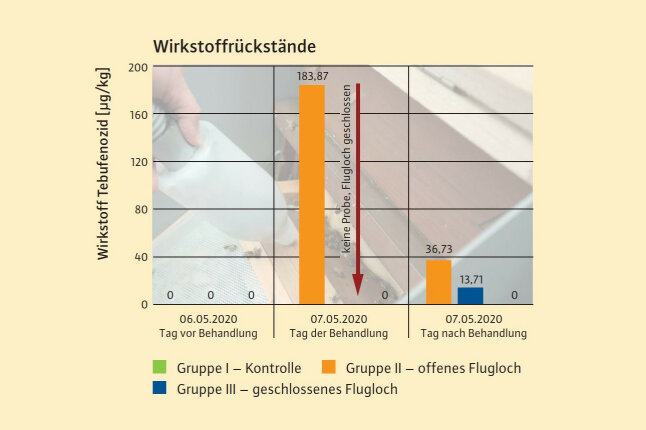
Abb. 4: Rückstände des Wirkstoffs in heimkehrenden Sammlerinnen am Tag vor der Behandlung, am Behandlungstag und am Tag nach der Behandlung. Dargestellt sind die Ergebnisse der Poolproben, die Sammlerinnen einer Gruppe wurden zu einer Probe zusammengefasst. In der Gruppe I (grün) war der Wirkstoff nicht nachweisbar, daher erscheint diese Säule nicht im Diagramm. LOQ = 1,0 µg/kg. (© LWF)
Diskussion
Mit 816–23.600 µg/kg erreichte der Wirkstoffeintrag im Pollen am Tag der Behandlung sehr hohe Werte. Thompson et al. (2005) konnten jedoch auch bei einer Applikation von 10 µg Tebufenozid pro Brutzelle keine negativen Effekte auf die Volksentwicklung nachweisen.
Die hohen Rückstandswerte von Tebufenozid beeinträchtigen eine mögliche Vermarktung des Pollens für den menschlichen Verzehr. Zwar ist nach aktuellem Kenntnisstand eine Gesundheitsgefährdung bei üblichen Verzehrmengen (5–10 g/Tag) selbst dann nicht zu erwarten, wenn die Pollenprobe mit der höchsten Tebufenozid-Belastung konsumiert wird. Erhebliche Rückstandsmengen von Pflanzenschutzmitteln in Blütenpollen werden jedoch vom Verbraucher nicht toleriert und gefährden das Image der Bienenprodukte als gesunde und natürliche Lebensmittel (DIB 2020).
Eine Belastung des Pollens konnte auch am Tag nach der Applikation nachgewiesen werden, jedoch in deutlich niedrigeren Wirkstoffkonzentrationen. Dennoch kommen die Bienen auch am Folgetag der Behandlung mit dem Wirkstoff in Kontakt. Dies bestätigen die Daten der Rückstandsanalyse von Pollenproben aus Bienenvölkern der Gruppe III, deren Tiere am Behandlungstag nicht sammeln konnten, sondern erst am Tag nach der Ausbringung von MIMIC®.
Vorsichtsmaßnahmen wie das Verschließen von Bienenvölkern reduzieren den Eintrag von Wirkstoffen, schließen ihn aber nicht völlig aus. Werden Fluglöcher zur Rückstandsminimierung verschlossen, sind abhängig vom verwendeten Beutensystem (Behausung des Bienenvolks) Vorsichtsmaßnahmen zu ergreifen: Die Völker sollten unbedingt über einen offenen Gitterbogen verfügen und beschattet werden, damit die Völker nicht ersticken oder überhitzen.
Zusammenfassung
Literatur
- Müller, A.; Huber, B. (2009): Titel der Veröffentlichung. Jahrbuch 2022, S. x–y
- Abramson C.I., Squire J., Sheridan A., Mulder P.G JR. (2004): Proboscis conditioning studies by using the insect growth regulators tebufenozide and diflubenzuron. Environmental Entomology 33 (2): 378–388
- Hahn A. Bischof J., Lobinger G., Müller-Kroehling S., Straßer L., Huber S., Hausknecht B., Aichmüller P., Lemme H.: Die Pflanzenschutzmitteleinsätze gegen den Schwammspinner in Franken in den Jahren 2018 bis 2020; in Stimm, K. (2021): Die Eiche; Facetten zu Ökologie, Naturschutz, Wachstum und waldbaulichen Perspektiven. Forstliche Forschungsberichte München, Nr. 221/2021.
- Illies I., Mühlen W., Dücker G. Sachser N. (2002): The influence of different bee traps on undertaking behaviour of the honey bee (Apis mellifera) and development of a new trap. Apidologie 33 (3): 315-326.
- Imdorf A., Bühlman G., Gerig L., Kilchenmann V., Wille H. (1987): Überprüfung der Schätzmethode zur Ermittlung der Brutfläche und der Anzahl Arbeiterinnen in freifliegenden Bienenvölkern. Apidologie 18 (2): 137-146.
- Smaaghe G., Eeelen H., Verschelde E., Richter K., Degheele D. (1996): Differential effects of nonsteroidal ecdysteroid agonists in Coleoptera and Lepidoptera: analysis of evagination and receptor binding in imaginal discs Insect Biochem. Mol. Biol. 26:687–95
- Thompson, H.M., Wilkins, S., Battersby, A.H., Waite R.J, Wilkinson D. (2005): The effects of four insect growth-regulating (IGR) insecticides on honeybee (Apis mellifera L.) colony development, queen rearing and drone sperm production. Ecotoxicology 14, 757–769.
Beitrag zum Ausdrucken
Weiterführende Informationen
Autoren
- Ingrid Illies

- Nicole Höcherl
- Andreas Schierling
- Andreas Hahn
- Stefan Huber
- Gabriela Lobinger
- Gabriela Bischoff

- Jens Pistorius




