Gregor Aas
Die Rotbuche: Verwandtschaft, Morphologie, Verbreitung und Ökologie - LWF Wissen 86
Die Rotbuche (Fagus sylvatica, Familie Fagaceae) ist in Mitteleuropa die häufigste und von Natur aus konkurrenzstärkste Baumart. Dargestellt werden die Verbreitung, Morphologie, nacheiszeitliche Rückwanderung, Ökologie und Reproduktionsbiologie der Rotbuche.
Die Gattung Fagus
 Zoombild vorhanden
Zoombild vorhanden
Abb. 1: Fagus grandifolia, die einzige neuweltliche Art der Gattung (© G. Aas)
Ihr großes Areal erstreckt sich vom Südosten Kanadas bis nach Florida und Nordmexiko. Sieben Fagus-Arten kommen in Ostasien, vor allem in China (z. B. Englers Buche, F. engleriana) und Japan (z. B. Japanische Buche, F. japonica) vor. In Europa ist neben der Rotbuche (F. sylvatica) die Orient-Buche (F. orientalis) beheimatet (siehe Kasten).
Morphologie
 Zoombild vorhanden
Zoombild vorhanden
Abb. 2: Freistehende Rotbuchen am Monte Baldo (© G. Aas)
In seltenen Fällen kommt es vor allem am Stammanlauf, aber auch immer wieder bei einzelnen Individuen, den sog. »Steinbuchen«, am gesamten Stamm zur Bildung einer rissigschuppigen Borke.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 3: Die Rinde der Rotbuche bleibt durch ein bis ins hohe Alter aktives Periderm dünn und glatt. (© G. Aas)
Kurztriebe sind im Unterschied dazu nur einige Millimeter bis wenige Zentimeter lang. Die zwei bis fünf Laubblätter stehen durch die extreme Stauchung der Internodien nahe, fast wirtelig beieinander. Die einzige gut ausgebildete Knospe des Kurztriebs ist die endständige, aus der das Wachstum im nächsten Jahr ohne seitliche Verzweigung fortgesetzt wird. So entstehen über mehrere Jahre unverzweigte Kurztriebketten, die gut und gerne 10 – 15 Jahre alt werden können (Abb. 6).
 Zoombild vorhanden
Zoombild vorhanden
Abb. 4: Schattenzweig einer Rotbuche (© G. Aas)
Im Zuge der Alterung von Buchen, aber auch bei Vitalitätsverlusten infolge von Stress, z. B. Trockenheit, vollzieht sich ein Umbau der Krone. Langtriebe werden immer weniger gebildet, Kurztriebe dagegen vermehrt. Bei alten oder geschädigten Bäumen kann bei weitgehendem Fehlen von Langtrieben der allergrößte Teil der Laubblätter an Kurztrieben stehen.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 5: Winterknospen der Rotbuche(© G. Aas)
Da die Rinde der Buche lang glatt bleibt, markiert diese Knospenspur viele Jahre die Grenzen aufeinanderfolgender Jahrestriebe, so dass man das Höhen bzw. Längenwachstum bis zu 30 Jahre zurückverfolgen kann.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 6: Vier Jahre alte Kurztriebkette im Winter. Die Grenzen der einzelnen Jahrestriebe sind gut an der Ringelung, der sog. Knospenspur oder Triebbasisnarbe zu erkennen. (© G. Aas)
Bei jungen, im Licht stehenden Pflanzen kann Syllepis (= Verzweigung eines Triebes ohne vorheriges Knospenstadium) vorkommen, mitunter auch Johannistriebbildung (= vorzeitiger Knospenaustrieb), wenn gleich viel seltener als bei Eichen.
Aus lichtökologischer Sicht bemerkenswert ist die Phänologie der Belaubung im Frühjahr: Buchenkronen ergrünen von unten nach oben, im Bestand die unterständigen Individuen vor den höheren. Diese frühere Belaubung optimiert die Lichtausbeute im Unterstand, geschützt vor Spätfrösten, bevor das Kronendach des Buchenwaldes voll belaubt ist.

Abb. 7: Laubblätter der Rotbuche. (© G. Aas)
Nacheiszeitliche Rückwanderung
Nicht sicher geklärt ist, zu welchen Anteilen die Ausbreitung durch ein humides, buchenfreundliches Klima, durch das Ausbreitungspotenzial der Art (z. B. Effektivität der Samenvektoren) oder durch den Menschen bestimmt bzw. limitiert war (Saltré et al. 2013). Durch ein zunehmend gemäßigteres, humides Klima im Subboreal und im Subatlantikum (vor etwa 2500 Jahren) wurde die Konkurrenzkraft der Buche gegenüber den Arten der zu dieser Zeit vorherrschenden Eichenmischwälder gestärkt. Möglicherweise aber wurde die Buchenausbreitung auch anthropogen gefördert. Schon zur Zeit der Ankunft der Buche in Mitteleuropa hat der Mensch immer wieder den Wald zugunsten von Landwirtschaft aufgelichtet oder gerodet, danach aber das Land wieder verlassen (Wanderwirtschaft, shifting cultivation). Die daraufhin einsetzende sukzessive Wiederbewaldung könnte, so die Annahme (Küster 1997, Bradshaw et al. 2010), die Ausbreitung der Buche begünstigt haben.
Verbreitung und Ökologie
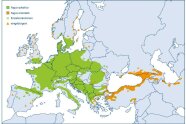 Zoombild vorhanden
Zoombild vorhanden
Abb. 8: Areal von Fagus sylvatica (grün) und Fagus orientalis (orange) (verändert nach EUFORGEN)
Die Ausbreitung der Rotbuche ist im Norden und Osten ihrer aktuellen Verbreitung wahrscheinlich noch gar nicht abgeschlossen. Fraglich ist deshalb, ob die tatsächliche Buchenverbreitung der ökologisch und klimatisch möglichen Verbreitung entspricht (Czajkowski et al. 2006). In vielen Randgebieten ihres Areals erweist sich die Buche als »expansiv«. Pollenanalytische Belege zeigen zudem, dass sie an ihrer Nordostgrenze ehemals weiter im Osten vorkam, dann aber, wahrscheinlich durch den Menschen, zurückgedrängt wurde. Wichtig sind diese Befunde, wenn es um die Einschätzung der Toleranz der Buche gegenüber stärker kontinentalem, trockenerem Klima geht, konkret bei der Frage nach ihrer Anpassungsfähigkeit an den Klimawandel.
Günstig für die Vitalität von Fagus sylvatica sind ein ausgeglichen humides Klima, tiefgründige, nachhaltig frische, ausreichend basenversorgte, gut durchlüftete und drainierte Böden. Unter geeigneten Klimabedingungen gelangt sie weitgehend unabhängig vom geologischen Untergrund zur Vorherrschaft. Die Spannbreite von Standorten mit Buchenwäldern reicht von stark sauren, nährstoffarmen Böden (z. B. HainsimsenBuchenwald, Luzulo-Fagetum) über mäßig saure, basenhaltige Substrate (z. B. WaldmeisterBuchenwald, Galio odorati-Fagetum) bis zu flachgründigen Kalkstandorten (z. B. SeggenBuchenwald, Carici-Fagetum, Walentowski et al. 2013). In Bayern würden von Natur aus neun Buchen und BuchenmischwaldGesellschaften rund 85 % der Waldfläche einnehmen. Unter natürlichen Bedingungen könnten sich in weiten Teilen Mitteleuropas andere Baumarten auf Dauer nur dort mehr oder weniger gut gegenüber der Klimaxbaumart Buche durchsetzen, wo das Klima oder andere Standortfaktoren deren Vitalität einschränken oder sie ganz ausschließen. Limitierend für die Buche sind (Durrant et al. 2016, Felbermeier und Mosandl 2011, Gayer 1882):
- die Länge der Vegetationszeit von mindestens etwa 140 Tagen; dadurch bedingt ist die Höhengrenze im Gebirge und die Verbreitungsgrenze im Norden;
- hohe Sommertemperaturen, Trockenheit (Jahresniederschläge unter 500 – 600 mm), starke Kontinentalität des Klimas (Spätfröste!);
- Sauerstoffmangel im Boden (Überflutung, hochanstehendes Grund oder Stauwasser, wechselfeuchte und insbes. dicht gelagerte Tonböden);
- durch Hangschutt und blockreiche Standorte bewegte Böden im Gebirge mit häufigem Steinschlag.
Reproduktion
 Zoombild vorhanden
Zoombild vorhanden
Abb. 9: Männliche Blütenstände. (© G. Aas)
Wie häufig es zu Mastjahren kommt, hängt von verschiedenen Faktoren ab. Neuere Untersuchungen zeigen, dass die Klimaerwärmung bei der Buche zwar zu verstärkter Samenbildung führt, aber die JahrzuJahrVariation in der Intensität der Fruktifikation sich abschwächt, d. h. das Mastverhalten weniger stark ausgeprägt ist (Bogdziewicz et al. 2020).
Dadurch können sich die vorteilhaften populationsbiologischen Effekte der Mastfruktifikation – höherer Reproduktionserfolg durch erhöhte Effizienz der Bestäubung und Sättigung der Samenprädatoren – längerfristig abschwächen. Samenprädatoren hingegen könnten so vom erhöhten Nahrungsangebot profitieren.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 10: Starke Fruktifikation, sog. Vollmast, bei der Rotbuche. (© G. Aas)
Der Samen wird vor allem von den zwei fleischigen, gefalteten Keimblättern (Speicherkotyledonen) ausgefüllt. Bucheckern haben eine endogene Keimhemmung (Samenruhe), die in der Natur den Winter über abgebaut wird, so dass die Samen im Frühjahr nach ihrer Reife epigäisch keimen (Abb. 12). Die beiden nierenförmigen Keimblätter sind für kurze Zeit photosynthetisch aktiv, ehe sie von zwei gegenständigen Primärblättern in der Blattfolge abgelöst werden.
F. sylvatica treibt nur mäßig gut durch proventive (schlafende) und adventive (neu gebildete) Knospen aus dem Stock aus (Abb. 13). Gelegentlich kann sie nahe am Stock und an den Wurzelanläufen auch Wurzelsprosse (Wurzelbrut) bilden. Interessanterweise sind diese Formen der vegetativen Reproduktion in den Südalpen und im Apennin häufiger zu beobachten als nördlich der Alpen.

Abb.11: Die Nussfrüchte der Buche, die Bucheckern, reifen zu zweit im Fruchtbecher (Cupula), der sich mit vier Klappen öffnet, um die Früchte zu entlassen. (© G. Aas)

Abb. 12: Dicht auflaufende Keimlinge im Frühjahr nach einer Vollmast. (© G. Aas)

Abb. 13: Fagus sylvatica treibt weniger gut aus dem Stock aus als viele andere Laubbaumarten. Auf der Alpensüdseite jedoch, im Bild eine Buche im schweizerischen Tessin, ist eine Regeneration durch Stockausschläge aus schlafenden Knospen häufig zu beobachten. (© O. Holdenrieder)
Steckbrief Rotbuche (Fagus sylvatica)
Gestalt
Bis 35 (max. 45) m hoher, sommergrüner Laubbaum mit dicht verzweigter, ausladender Krone, Brusthöhendurchmesser (BHD) bis 1,5 m, selten bis 2,5 m; Äste meist schräg nach oben gerichtet, im Freistand kurzstämmig mit weit ausladender Krone, im geschlossenen Bestand mit ± astfreiem Stamm und schmaler Krone; Sprosssystem deutlich gegliedert in Lang- und Kurztriebe
Knospen
Zweizeilig angeordnet; von der Sprossachse abstehend, spindelförmig, lang und dünn, mit zahlreichen braunen Schuppen; Blütenknospen deutlich dicker, ± elliptisch
Blätter
Zweizeilig angeordnet; Blattstiel 0,5 – 1 (– 1,5) cm lang, Spreite eiförmig bis elliptisch, 5 – 10 (– 15) cm lang, mit 5 – 9 Paar Seitennerven, am Rand etwas wellig, ganzrandig oder entfernt schwach gezähnt, anfangs seidig behaart, später kahl
Rinde
Silbergrau, bis ins hohe Alter glatt; keine oder nur selten Bildung einer Borke
Blüten
Ende April und Mai, mit dem Laubaustrieb; eingeschlechtig und einhäusig verteilt, die männlichen in lang gestielten, schlaff hängenden, vielblütigen Knäueln (Kätzchen); jede Blüte mit 5 – 15 Staubblättern; die weiblichen paarweise in einem unscheinbaren, aufrechten, kurz gestielten Blütenstand, dieser bis auf die Narben von einem dicht weichstacheligen Fruchtbecher (Cupula) umgeben; Bestäubung durch den Wind
Früchte
Reife im September, Oktober; je zwei scharf dreikantige, 1 – 2 cm lange, braune, meist einsamige Nüsse (Bucheckern) in einem anfangs geschlossenen, braunen, verholzten, weichstacheligen Fruchtbecher (Cupula), der sich zur Reifezeit mit vier Klappen öffnet; Ausbreitung durch Schwerkraft (Barochorie, »Plumpsfrüchte«) sowie durch Vögel und Kleinsäuger
Bewurzelung
Herzwurzelsystem mit hohem Feinwurzelanteil, dichte Bodenerschließung vor allem im Nahbereich des Stocks; oft Wurzelverwachsungen
Höchstalter
300 bis 400 Jahre
Chromosomenzahl
2n = 24
Literatur
- Bartels, H. 1993: Gehölzkunde. Stuttgart: Ulmer, 336 S.
- Bogdziewicz, M. et al. 2020: Climate warming disrupts mast seeding and its fitness benefits in European beech. Nature Plants 6: 88–94
- Bradshaw, R.H.W.; Kito, N.; Giesecke, T. 2010: Factors influencing the Holocene history of Fagus. Forest Ecology and Management 259: 2204–2212
- Czajkowski, T.; Kompa, T.; Bolte, A. 2006: Zur Verbreitungsgrenze der Buche (Fagus sylvatica L.) im nordöstlichen Mitteleuropa. Forstarchiv 77: 203–216
- Durrant, T.H., de Rigo, D., Caudullo, G., 2016: Fagus sylvatica and other beeches in Europe: distribution, habitat, usage and threats. In:
- San-Miguel-Ayanz, J. et al. (Eds.): European atlas of forest tree species. Publ. Off. EU, Luxembourg: 94-95
- Felbermeier, B.; Mosandl, R. 2011: Die Buche. Nue Perspektiven für Europas dominierende Laubbaumart. LWF aktuell 85: 25-27
- Fleischhauer, S.G.; Guthmann, J.; Spiegelberger, R. .2013: Enzyklopädie Essbare Nutzpfklanzen. Aarau: AT Verlag. 682 S.
- Gayer, K. 1882: Der Waldbau. 2. Aufl. Berlin: Parey, 592 S.
- Jiang, Lu et al. 2020: Phylogeny and biogeography of Fagus (Fagaceae) based on 28 nuclear single/low‐copy loci. Journal of Systematics and Evolution: 1-14. D, D.oi: 10.1111/jse.12695
- Küster, H. 1997: The role of farming in the postglacial expansion of beech and hornbeam in the oak woodlands of central Europe. The Holocene 7: 239-242
- Magri, D. et al. 2006: A new scenario for the Quaternary history of European beech populations: palaeobotanical evidence and genetic consequences. New Phytologist: 1-23. Doi : 10.1111/j.1469-8137.2006.01740.x
- Saltré, F. et al. 2013: Climate or migration: what limited European beech post-glacial colonization? Global Ecol. Biogeogr. 1-11. DOI: 10.1111/geb.12085
- Walentowski, H.; Ewald, J.; Fischer, A.; Kölling, C.; Türk, W. 2013: Handbuch der natürlichen Waldgesellschaften Bayerns. 3. Aufl. Freising: Geobotanica, 441 S.





