Ausbreitung von Ilex aquifolium als Beitrag zur Laurophyllisierung mitteleuropäischer Wälder? – LWF Wissen 85
von Jörg Ewald
 Zoombild vorhanden
Zoombild vorhanden
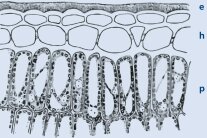
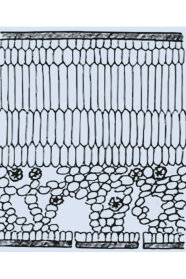
Abbildung 1 a: Querschnitt durch das Oberblatt der Stechpalme mit Epidermis und Wachschicht (e), Hypodermis (h) und Palisadenparenchym (p) (© Hegi)
Mit immergrünem, hartem Laub, geringer Trocken- und hoher Schattentoleranz ist Ilex aquifolium die frosttoleranteste unter den laurophyllen Baumarten des ozeanischen Europa, wo nur Relikte des arktotertiären Lorbeerwald-Bioms die Eiszeit überlebten. Die im Tessin und in Irland als Laurophyllisierung beschriebene Unterwanderung warmtemperierter Eichenmischwälder mit exotischen Gartenflüchtlingen ist in Mitteleuropa trotz steigender Wintertemperaturen noch nicht feststellbar.
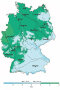
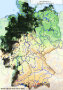
Entlang der Randalpen gedeiht Ilex aus ungeklärten Gründen in Frosthärtezone 6 und erreicht seine östlichste Verbreitung nördlich der Alpen. Die an Hand von Klimaensembles für 2080 ermittelten Analoggebiete des niederschlagsreichen bayerischen Alpenrandes begünstigen laurophylle Vegetation, was eine Ausbreitung von Ilex und anderen immergrünen Gehölzen im Klimawandel erwarten lässt.
Ilex als laurophylle Baumart
 Zoombild vorhanden
Zoombild vorhanden
Abbildung 1 b: Querschnitt durch ein Lichtblatt des Efeus mit mehrreihigem Palisadenparechnchym (© Hegi)
So besitzt die Epidermis von Ilex eine dicke, glänzende Wachsschicht und wird auf der Blattoberseite durch eine Hypodermis versteift (Abbildung 1 a). Darunter folgt ein mehrzeiliges, von außen dunkelgrün wirkendes Palisaden und ein lockeres Schwammparenchym, das wie bei Fagus sylvatica nach unten von einer einfachen Epidermis ohne besonderen Verdunstungsschutz (Behaarung oder eingesenkte Spaltöffnungen) abgeschlossen wird.
Einen vergleichbaren Gewebeaufbau findet man bei Lichtblättern des Efeu (Hedera helix, Abbildung 1 b), die Fröste bis zu – 25 °C tolerieren (Andergassen & Bauer 2002). Stechpalmen werden auf Grund ihres relativ harten Laubes, das unter anderem eine gewisse Forstabhärtung erlaubt, zu den sklero-laurophyllen Arten gerechnet (Box 1996). So ertragen abgehärtete Ilex-Zweige Fröste bis – 18 °C, während bei der weichlaubigeren Prunus laurocerasus bei – 12 °C, bei Laurus nobilis bereits bei – 10 °C Schäden an Laub und Knospen festgestellt wurden (Sakai 1981).
Das Biom der Lorbeerwälder
 Zoombild vorhanden
Zoombild vorhanden
Abbildung 2: Klimadiagramme aus den Lorbeerwald-Wuchs-gebieten von Asturien und der türkischen Schwarzmeerküste sowie aus dem Tessin und den Berchtesgadener Alpen, jeweils kollin-submontane Höhenstufe Quelle: https://www.klimadiagramme.de
Den europäischen Lorbeerwäldern stehen die euxinischen Wälder entlang der türkischen Schwarzmeerküste bis zum Westkaukasus nahe, denen die laurophyllen Neophyten Prunus laurocerasus und Rhododendron ponticum entstammen (Mayer & Aksoy 1986). Die in diesem Gebiet vorkommende Stechpalme (Ilex colchica) und Efeu (Hedera colchica) werden als eigene Arten betrachtet (Abbildung 2).
Laurophyllisierung als Prozess des Globalen Wandels
Laurophyllisierung in Mitteleuropa?
Ilex am Alpenrand: ein Baum mit Zukunft
| AELF | Irland/UK | Pyrenäen | Limousin | Burgund | Oberitalien | Dinariden | Kaukasus |
|---|---|---|---|---|---|---|---|
| Traunstein | + | + | + | + | |||
| Rosenheim | + | + | + | + | + | + | + |
| Miesbach | + | + | + | + | + | + | + |
| Weilheim | + | + | + | + | + | + | + |
| Kaufbeuren | + | + | + | + | + | + | + |
| Kempten | + | + | + | + | + | + | + |
| pNV | F1, F32 | F138,G41, F98, F33 | F82, F16 | F113, F36 | F17, F45 | F87, F47 | F163, F169 |
| Buche | (+) | + | + | + | + | + | F. orientalis |
| Eiche | + | Q. pubescens, Q. ilex | + | + | Q. cerris | Q. cerris | Q. iberica |
| Esskastanie | (+) | (+) | (+) | + | + | ||
| Hainbuche | + | + | + | +, C. orientalis | |||
| Ilex | + | + | + | I. colchica | |||
| Hedera | + | + | + | + | H. colchica | ||
| Taxus | + | + | + | ||||
| Laurophylle | Rhododendron ponticum | Buxus semperivirens Daphne laureola Pistacia terebinthus | Prunus lauroceraus Rhododendron ponticum Hedera colchica Ruscus colchicus Daphne pontica |
Danksagung
Die Recherche zu diesem Beitrag erfolgte im Rahmen des Projektes »Die Stechpalme im Gebiet der bayerischen Voralpen: Vorkommen und Genetik« mit freundlicher Unterstützung durch Heinrich Schäfer, Fischbachau, dem Förderverein des Zentrums Wald-Forst-Holz Weihenstephan und des Bayerischen Forstvereins. Dank gebührt auch Christian Kölling, Tobias Mette, Olaf Schmidt und Hanno Schäfer für die kritische Durchsicht des Manuskriptes.
Summary
Literatur
- Alessi, N.; Těšitel, J.; Zerbe, S.; Spada, F.; Agrillo, E.; Wellstein, C. (2019): Ancient refugia and present‐day habitat suitability of native laurophylls in Italy. Journal of Vegetation Science 30 (3): 564–574. DOI: 10.1111/jvs.12743.
- Andergassen, S.; Bauer, H. (2002): Frost hardiness in the juvenile and adult life phase of ivy (Hedera helix L.). Plant Ecology 161(2): 207–213. DOI: 10.1023/A:1020365422879.
- Bañuelos, M. J.; Kollmann, J.; Hartvig, P.; Quevedo, M. (2003): Modelling the distribution of Ilex aquifolium at the north-eastem edge of its geographical range. Nordic Journal of Botany 23 (1): 129–142. DOI: 10.1111/j.1756-1051.2003.tb00374.x.
- Bayerische Landesanstalt für Wald und Forstwirtschaft (2021): Klimaanalogie-Karten für Bayern. https://www.lwf.bayern.de/boden-klima/baumartenwahl/068395/index.php abgerufen am 18.2.2021.
- Berger, S.; Söhlke, G.; Walther, G.-R.; Pott, R. (2007): Bioclimatic limits and range shifts of cold-hardy evergreen broad-leaved species at their northern distributional limit in Europe. Phytocoenologia 37 (3-4): 523–539. DOI: 10.1127/0340-269X/2007/0037-0523.
- Bohn, U.; Gollub, G.; Hettwer, C.; Neuhäuslová, Z.; Raus, T., Schlüter, H.; Weber, H. (2004): Karte der natürlichen Vegetation Europas/Map of the Natural Vegetation of Europe, Maßstab/Scale 1. 2500000, Interaktive/Interactive CD-ROM. Bonn.
- Box, E. O. (1996): Plant functional types and climate at the global scale. Journal of Vegetation Science 7 (3): 309–320. DOI: 10.2307/3236274.
- Carraro, G.; Gianoni, P.; Kemper, A.; Boggia, S.; Ceschi, I.; Frehner, M. (2020): La vegetazione forestale della Valle Onsernone e le sue tendenze evolutive. Con carta della vegetazione 1:25 000. Bern: Haupt Verlag (Bristol-Schriftenreihe).
- Conedera, M.; Wohlgemuth, T.; Tanadini, M.; Pezzatti, G. B. (2018): Drivers of broadleaved evergreen species spread into deciduous forests in the southern Swiss Alps. Regional Environmental Change 18 (2): 425–436. DOI: 10.1007/s10113-017-1212-7.
- Cross, J. R. (1975): Rhododendron ponticum L. Jorunal of Ecology 63 (1): 345-364. DOI: 10.2307/2258859.
- Dehnen-Schmutz, K.; Perrings, C.; Williamson, M. (2004): Controlling Rhododendron ponticum in the British Isles: an economic analysis. Maintaining Forest Biodiversity 70 (4): 323–332. DOI: 10.1016/j.jenvman.2003.12.009.
- Diekmann, M. (2010): Aktuelle Vegetationsveränderungen in Wäldern -Welche Rolle spielt der Klimawandel? Berichte der Reinhold-Tüxen-Gesellschaft 22: 57–65.
- Dierschke, H. (2005): Zur Lebensweise, Ausbreitung und aktuellen Verbreitung von Hedera helix, einter ungewöhnlichen Pflanze unserer Flora und Vegetation. Hoppea, Denkschriften der Regensburgischen Botanischen Gesellschaft 66: 187–206.
- Dobbertin, M.; Hilker, N.; Rebetez, M.; Zimmermann, N. E.; Wohlgemuth, T.; Rigling, A. (2005): The upward shift in altitude of pine mistletoe (Viscum album ssp. austriacum) in Switzerland - the result of climate warming? International Journal of Biometeorology 50 (1): 40–47. DOI: 10.1007/s00484-005-0263-5.
- Doyle, G. (1999): Laurophyllisation in Ireland - the case of Rhododendron ponticum. In: F. Klötzli, G.-R. Walther (Hrsg.): Conference on Recent Shifts in Vegetation Boundaries of Deciduous Forests, Especially Due to General Global Warming. Basel: Birkhäuser Basel (Monte Verità, Proceedings of the Centro Stefano Franscini Ascona): S. 237–251.
- Deutscher Wetterdienst (2021): Deutscher Klimaatlas. https://www.dwd.de/DE/klimaumwelt/klimaatlas/klimaatlas_node.html abgerufen am 19.2.2021
- Eberle, G. (1961): Die Stechpalme (Ilex aquifolium), ein Gehölz des Alpenwaldes. Jahrbuch des Vereins zum Schutz der Alpenpflanzen und -Tiere 26: 118–121.
- Frank, D. (2018): Die Lorbeerkirsche (Prunus laurocerasus L.) – ein oft gepflanzter Zierstrauch mit invasivem Potential. Mitteilungen der floristischen Kartierung Sachsen-Anhalt 23: 27–39.
- Fuchs, R.; Hetzel, I.; Loos, G. H.; Keil, P. (2006): Verwilderte Zier- und Nutzgehölze in Wäldern des Ruhrgebiets. AFZ/Der Wald (12/2006): 622–625.
- Gottfried, M.; Pauli, H.; Futschik, A.; Akhalkatsi, M.; Barančok, P.; Benito Alonso, J. L. et al. (2012): Continent-wide response of mountain vegetation to climate change. Nature Climate Change 2(2): 111–115. DOI: 10.1038/nclimate1329.
- Groom, Q. J.; Baker, N. R.; Long, S. P. (1991): Photoinhibition of holly (Ilex aquifolium) in the field during the winter. Physiologia Plantaraum 83 (4): 585–590. DOI: 10.1111/j.1399-3054.1991.tb02472.x.
- Habitats Committee (2013): Interpretation Manual of European Union Habitats, version EUR 28. European Commission, DG-ENV. Available online at http://ec.europa.eu/environment/nature/legislation/habitatsdirective/docs/Int_Manual_EU28.pdf.
- Hegi, G. (1975): Illustrierte Flora von Mitteleuropa. V. Band, 1. Teil Dicotyledones 3. Teil Linaceae - Violaceae. With assistance of H. Gams, W. Lüdi, H. Beger, J. Braun-Blanquet, A. Thellung, W. Zimmermann. Hamburg: Verlag Paul Parey (Illustrierte Flora von Mitteleuropa, V.1).
- Hegi, Gustav (1975): Illustrierte Flora von Mitteleuropa. V. Band 2. Teil Dicotyledones 3. Teil Cactaceae - Cornaceae. With assistance of Herbert Berger, Heinrich Marzell.
- Heinze, W.; Schreiber, D. (1984): Eine neue Kartierung der Winterhärtezonen für Gehölze in Mitteleuropa. Mitteilungen der Deutschen Dendrologischen Gesellschaft 75: 11–56.
- Iversen, J. (1944): Viscum, Hedera and Ilex as Climate Indicators. Geologiska Föreningen i Stockholm Förhandlingar 66 (3): 463–483. DOI: 10.1080/11035894409445689.
- Kaiser, T. (2019): Weitere Neufunde der Laubholz-Mistel (Viscum album L. subsp. album) in Niedersachsen. Floristische Notizen aus der Lüneburger Heide 27: 13–21.
- Klötzli, F.; Walther, G.-R. (Hrsg.) (1999): Conference on Recent Shifts in Vegetation Boundaries of Deciduous Forests, Especially Due to General Global Warming. Basel: Birkhäuser Basel (Monte Verità, Proceedings of the Centro Stefano Franscini Ascona).
- Mayer, H.; Aksoy, H. (1986): Wälder der Türkei. Stuttgart: Fischer.
- Metcalfe, D. J. (2005): Hedera helix L. Journal of Ecology 93 (3): 632–648. DOI: 10.1111/j.1365-2745.2005.01021.x.
- Niinemets, U.; Valladares, F.; Ceulemans, R. (2003): Leaf-level phenotypic variability and plasticity of invasive Rhododendron ponticum and non-invasive Ilex aquifolium co-occurring at two contrasting European sites. Plant, Cell & Environment 26 (6): 941–956. DOI: 10.1046/j.1365-3040.2003.01027.x.
- Pfadenhauer, J. S.; Klötzli, F. (2014): Vegetation der Erde. Grundlagen, Ökologie, Verbreitung. Berlin: Springer Berlin.
- Pott, R. (1990): Die nacheiszeitliche Ausbreitung und heutige pflanzensoziologische Stellung von Ilex aquifolium L. Tuexenia 10: 497–512.
- Roloff, A.; Bärtels, A. (2018): Flora der Gehölze. Bestimmung, Eigenschaften, Verwendung. 5., aktualisierte Auflage. Stuttgart: Ulmer.
- Sakai, A. (1981): Freezing Resistance of Broad-Leaved Evergreen Trees in the Warm-Temperate Zone. Low temperature science. Ser. B, Biological sciences 38: 1–14.
- Sakai, A.; Larcher, W. (1987): Frost survival of plants. Responses and adaptation to freezing stress. Berlin: Springer (Ecological studies, 62).
- Sendtner, O. (1854): Die Vegetationsverhältnisse Südbayerns nach den Grundsätzen der Pflanzengeographie und mit Bezugnahme auf die Landeskultur. München: Literarisch-artistische Anstalt.
- Schmeller, J. A.; Frommann, G. C. (1872): Bayerisches Wörterbuch. Sammlung von Wörtern und Ausdrücken, die in den lebenden Mundarten sowohl, als in der älteren und ältesten Provincial-Litteratur des Königreichs Bayern, besonders seiner ältern Lande, vorkommen, und in der heutigen allgemein-deutschen Schriftsprache entweder gar nicht, oder nicht in denselben Bedeutungen üblich sind. 2., mit des Verfassers Nachträgen vermehrte Ausgabe / bearb. von G. Karl Frommann, Bd.: 1, Enthaltend Theil I. und II. der ersten Ausgabe. München.
- Schultz, J. (2016): Die Ökozonen der Erde. 5., vollständig überarbeitete Auflage. Stuttgart: Verlag Eugen Ulmer (UTB Geowissenschaften, Ökologie, Agrarwissenschaften, 1514).
- Szmidla, H.; Tkaczyk, M.; Plewa, R.; Tarwacki, G.; Sierota, Z. (2019): Impact of Common Mistletoe (Viscum album L.) on Scots Pine Forests - A Call for Action. Forests 10 (10): 847. DOI: 10.3390/f10100847.
- Tschermak, L. (1935): Vorarlberg. In: L. Tschermak (Hrsg.): Die natürliche Verbreitung der Lärche in den Ostalpen. Ein Beitrag zur Ableitung der Standortsansprüche der Lärche. Vienna, s.l.: Springer Vienna: S. 136–146.
- Veste, M.; Kriebitzsch, W.-U. (2019): Photosyntheseverhalten der Stechpalme (Ilex aquifolium L.) in milden Winter in Mitteleuropa: Ein ökophysiologischer Vorteil durch den Klimawandel? Allgemeine Forst- und Jagd-Zeitung 189: 143–153.
- Vollmann, Franz (1914): Flora von Bayern. Stuttgart: Ulmer.
- Wachendorf, M.; Schloz, M.; Küppers, M.; Güney, A.; Veste, M. (2019): Wintertime photosynthesis and spring recovery of Ilex aquifolium L. iForest 12 (4): 389–396. DOI: 10.3832/ifor2983-012.
- Walter, H.; Breckle, S.-W. (1999): Vegetation und Klimazonen. Grundriß der globalen Ökologie. 7., völlig neu bearb. und erw. Aufl. Stuttgart: Ulmer (UTB für Wissenschaft Uni-Taschenbücher, 14).
- Walther, G.-R. (1999): Distribution and limits of evergreen broad-leaved (laurophyllous) species in Switzerland. Botanica Helvetica 109: 153–167. DOI: 10.5169/SEALS-73293.
- Wikipedia (2021): Laurophyllie. https://de.wikipedia.org/wiki/Laurophyllie aufgerufen am 17.2.2021.