Artenvielfalt in Mulmhöhlen: Einfluss von Waldstruktur und Höhleneigenschaften - LWF aktuell 135
von Benjamin Henneberg, Heike Feldhaar, Elisabeth Obermaier
 Zoombild vorhanden
Zoombild vorhanden
Abb. 1: Schnellkäfer (© A. Haselböck, www.naturspaziergang.de)
Spätestens seitdem der Bayerische Ministerrat im Jahr 2008 die Strategie zum Erhalt der biologischen Vielfalt in Bayern – kurz: Bayerische Biodiversitätsstrategie – beschlossen hat, steht neben der Sicherung der Artenvielfalt auch der Erhalt der Lebensraumvielfalt auf der Agenda.
Ein wichtiger Lebensraumtyp für die Artenvielfalt in Wäldern sind sogenannte Mulmhöhlen – Faulhöhlen in lebenden Bäumen, die sich in der Regel in alten Laubbäumen entwickeln (Nadelbäume erschweren aufgrund des starken Harzflusses die Bildung von Höhlen).
Mulmhöhlen bilden sich vor allem in höherem Baumalter, ihre Entwicklung dauert viele Jahre. Bei Eichen zum Beispiel nimmt die Wahrscheinlichkeit der Höhlenbildung ab einem Alter von etwa 200 Jahren stark zu (Ranius et al. 2009).
Xylobionte Mulmhöhlenbewohner – der Wohnraum ist knapp
Mulmhöhlen bieten Lebensraum für zahlreiche Tiergruppen. Die größte Gruppe bilden die Gliederfüßer (Arthropoden), hiervon vor allem Fliegen und Mücken (Dipteren), Käfer (Coleopteren), aber auch Milben (Acari) und Springschwänze (Collembola). Mulmhöhlen sind außerdem ein Habitat für höhlenbrütende Vögel und Säugetiere, wie z. B. Fledermäuse. Folglich stellen Mulmhöhlen Schlüsselstrukturen für eine hohe Artenvielfalt im Wald dar (Müller et al. 2014). Da alte Höhlenbäume aufgrund des geringen wirtschaftlichen Werts in der Vergangenheit häufig entfernt wurden, zählen Mulmhöhlen heute zu den seltensten Strukturen in mitteleuropäischen Wäldern (Lindenmayer et al. 2012). Diese Lebensraumknappheit hat zur Folge, dass vor allem die Mulmhöhlenspezialisten unter den Käfern, also Arten, die nur in Mulmhöhlen ihre Larvalentwicklung vollziehen können, zu den gefährdetsten Tiergruppen gehören. Etwa 75 % von ihnen stehen auf der Roten Liste (Schmidl & Büche 2018).
So vielfältig wie ihre Bewohner sind Mulmhöhlen auch in Bezug auf ihre Eigenschaften (Micó et al. 2015; Schauer et al. 2018). Es gibt große und kleine Mulmhöhlen, Höhlen mit großflächigem oder kleinem Eingang, feuchte und weniger feuchte Höhlen, Höhlen mit grobem, wenig zersetztem Mulm oder solche mit dunklem, stark zersetztem Mulm. Auch die Habitatansprüche der Mulmhöhlenbewohner sind sehr unterschiedlich. Manche Arten besiedeln nur sehr feuchte Höhlen, andere nur tiefgelegene Höhlen mit Kontakt zum Waldboden oder ausschließlich große Höhlen. Diese besonderen Ansprüche vieler Arten verringern das Angebot an passenden Mulmhöhlen zusätzlich.
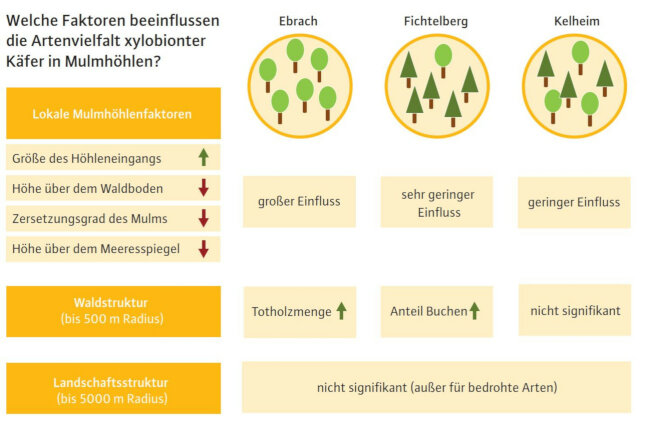
Abb. 2: Umweltfaktoren, die die Artenvielfalt xylobionter Käfer in den untersuchten Mulmhöhlen beeinflussen. Grüner Pfeil = positiver Einfluss (z. B. je größer der Höhleneingang, desto höher die Artenvielfalt), roter Pfeil = negativer Einfluss (z. B. je höher der Zersetzungsgrad des Mulms, desto geringer die Artenvielfalt). Die jeweilige Baumartenzusammensetzung der drei Waldgebiete wird durch das Verhältnis von Laub und Nadelbäumen in den Kreisen visualisiert. (© LWF)
Forstliche Forschung: Vergleich dreier Waldgebiete
 Zoombild vorhanden
Zoombild vorhanden
Abb. 3: Mulmhöhle in einer Rotbuche im Forstbetrieb Ebrach. Höhleneingang etwa 80 cm über dem Waldboden © B. Henneberg, Universität Bayreuth
Neben dem Forstbetrieb Ebrach, der sich durch Eichen- und Buchenbestände auszeichnet, wurde der Forstbetrieb Kelheim untersucht, der gemischte Laub- und Nadelwälder aufweist, sowie der Forstbetrieb Fichtelberg, der durch montane, fast reine Fichtenbestände mit gelegentlichen Laubbaumvorkommen charakterisiert ist (Abbildung 2). In jedem der drei Waldgebiete wurden in den Jahren 2018 und 2019 jeweils einmal 40 bis 50 Mulmhöhlen in Rotbuchen mit Emergenzfallen beprobt. Dabei wurden die von April bis September aus den Mulmhöhlen entweichenden Insekten gefangen und in Alkohol konserviert. Dieses Verfahren hat den Vorteil, dass es nicht invasiv ist und die wertvollen Mulmhöhlen sowie der darin befindliche Mulm intakt bleiben (Schauer et al. 2018). Die Larvalentwicklung von mulmhöhlenbewohnenden Käfern erstreckt sich in der Regel über mehrere Jahre – folglich sind Larven, die im Jahr der Beprobung ihre Entwicklung noch nicht vollendet hatten, in den Höhlen verblieben und können in den Folgejahren schlüpfen.
Lokale Eigenschaften der Mulmhöhlen von großer Bedeutung
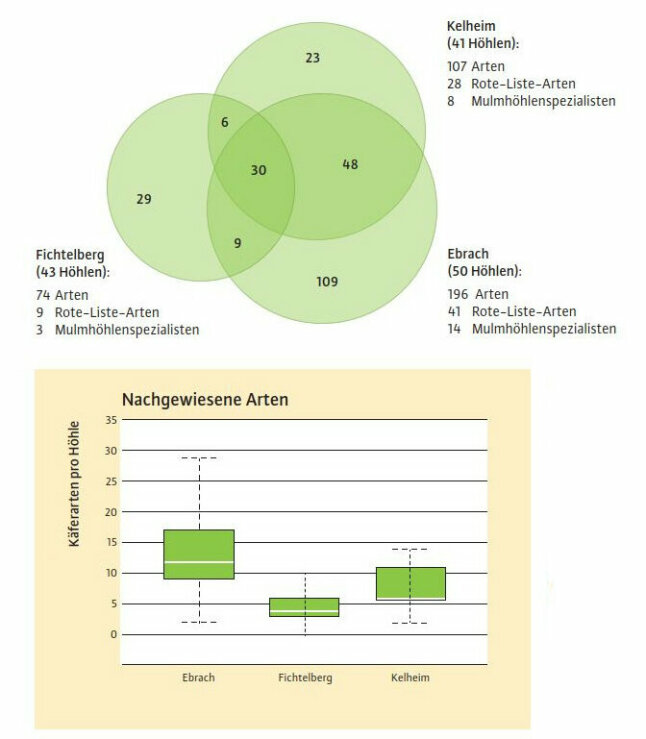
Abb. 4: Artenvielfalt xylobionter Käfer in den untersuchten Mulmhöhlen der drei Waldgebiete. Arten, die in zwei oder mehr Waldgebieten nachgewiesen wurden, werden durch die Schnittmengen dargestellt (oben). Boxplots visualisieren die Anzahl xylobionter Käferarten pro Höhle, die in den drei Waldgebieten nachgewiesen wurden (unten) (© LWF)
Bedeutung der Waldstruktur
 Zoombild vorhanden
Zoombild vorhanden
Abb. 5: Emergenzfalle an einer Rotbuche im Forstbetrieb Ebrach (© B. Henneberg, Universität Bayreuth)
In Fichtelberg gab es nur vereinzelte Laubholz-Mulmhöhlen. Sind Mulmhöhlen in einem Gebiet selten und isoliert, scheint die Qualität der einzelnen Höhlen kaum noch eine Rolle zu spielen – Mulmhöhlenbewohner nehmen, was sie kriegen können. Dementsprechend beeinflusste im Nadelwald einzig der Anteil an Buchen in der näheren Umgebung der untersuchten Mulmhöhlen die Artenvielfalt in den Höhlen positiv (Abbildung 2). Da Buchen im Forstbetrieb Fichtelberg zumeist isoliert in einer Umgebung aus Nadelbäumen stehen, war das Vorhandensein weiterer Buchen im näheren Umkreis der Höhlenbäume (bis zu einem Radius von 100 m) der wichtigste Einflussfaktor für mulmhöhlenbewohnende Käfer in diesem Waldgebiet.
Totholz ist nicht gleich Totholz
Einfluss der Landschaftsstruktur auf Mulmhöhlenbewohner
Geringe Ausbreitungsfähigkeit von Mulmhöhlenspezialisten?
noch unbekannt (Feldhaar & Schauer 2018). Im Rahmen unserer Studie führten wir deshalb für zwei ausgewählte xylobionte Käferarten populationsgenetische Analysen durch. Die zwei Mulmhöhlenspezialisten, der Kammkäfer Eucnemis capucina und der Kurzflügelkäfer Hesperus rufipennis, wiesen – anders als bei zuvor von uns populationsgenetisch untersuchten Totholzgeneralisten – bereits innerhalb eines Waldgebiets wie dem Forstbetrieb Ebrach eine deutliche genetische Strukturierung auf. Diese könnte einerseits durch ein geringes Ausbreitungsvermögen der Käfer, die an das langlebige Habitat Mulmhöhle angepasst sind, bedingt sein. Andererseits weisen gerade solche Spezialisten häufig auch eine sehr kleine Populationsgröße auf, die zu ähnlichen Mustern führen würde.
Fazit
 Zoombild vorhanden
Zoombild vorhanden
Abb. 6: Anbringen einer höher gelegenen Emergenzfalle an einer Rotbuche. Höhleneingang etwa 350 cm über dem Waldboden (© V. Mertl, Universität Bayreuth)
Die Studie belegt, dass neben der Qualität der einzelnen Mulmhöhlen auch die Waldstruktur von Bedeutung für die Artenvielfalt der Mulmhöhlenbewohner ist. Folglich ist auch die Anreicherung von Totholz in Wirtschaftswäldern förderlich für den Schutz von Lebensgemeinschaften in Mulmhöhlen (Gossner et al 2013; Müller et al. 2015).
Insbesondere sollte Totholz von Laubbaumarten angereichert werden, da xylobionte Käfer nicht nur auf die Menge, sondern auch auf die Baumart sowie den Durchmesser, den Zersetzungsgrad und die Sonnenexposition von Totholz sensibel reagieren (Sverdrup-Thygeson et al. 2014; Seibold et al. 2016). Darüber hinaus hat sich die Baumartenzusammensetzung des jeweiligen Waldgebiets als sehr einflussreich für die xylobionte Artenvielfalt in Mulmhöhlen erwiesen. Deshalb würde auch eine Erhöhung des Laubbaumanteils in nadelholzdominierten Wirtschaftswäldern helfen, die Artenvielfalt xylobionter Käfer in Mulmhöhlen zu erhöhen.
Zusammenfassung
 Zoombild vorhanden
Zoombild vorhanden
Abb. 7: Der Kurzflügelkäfer: ein Mulmhöhlenspezialist (© P. H. Olsen, www.insects.at)
Die Studie zeigt, dass für die Artenvielfalt in den Mulmhöhlen insbesondere die Qualität der einzelnen Mulmhöhlen, die Waldstruktur sowie die Baumartenzusammensetzung von Bedeutung sind. Da Mulmhöhlen Schlüsselstrukturen für eine hohe Artenvielfalt im Wald darstellen, sollte besonderes Augenmerk auf den Schutz und Erhalt dieses Lebensraums gelegt werden.
Projekt
Das Projekt »Arthropodengemeinschaften in Mulmhöhlen im Landschaftskontext: Einfluss der Wald- und der Landschaftsstruktur auf Diversität und Ausbreitungsdistanzen im regionalen Vergleich (L58)« (Laufzeit: 01.04.1918–31.12.2021) wurde, ebenso wie das Vorgängerprojekt L56, durch das Bayerische Staatsministerium für Ernährung, Landwirtschaft und Forsten sowie die Oberfrankenstiftung finanziert.
Literatur
- Feldhaar, H., Schauer, B. (2018): Dispersal of saproxylic insects. In: Ulyshen M (Ed.) Saproxylic Insects. Zoological Monographs Vol. 1. Springer, Cham: 515-546.
- Gossner, M. M., Floren, A., Weisser, W. W., Linsenmair, K. E. (2013): Effect of dead wood enrichment in the canopy and on the forest floor on beetle guild composition. Forest Ecology and Management 302: 404-413.
- Gouix, N., Sebek, P., Valladares, L., Brustel, H., Brin, A. (2015): Habitat requirements of the violet click beetle (Limoniscus violaceus), an endangered umbrella species of basal hollow trees. Insect Conservation and Diversity 8: 418-427.
- Grove, S. J. (2002): Saproxylic insect ecology and the sustainable management of forests. Annual Review of Ecology and Systematics 33: 1-23.
- Henneberg, B., Bauer, S., Birkenbach, M., Mertl, V., Steinbauer, M. J., Feldhaar, H., Obermaier, E. (2021): Influence of tree hollow characteristics and forest structure on saproxylic beetle diversity in tree hollows in managed forests in a regional comparison. Ecology and Evolution 11: 17973-17999.
- Lindenmayer, D. B., Laurance, W. F., Franklin, J. F. (2012): Global decline in large old trees. Science 338: 1305-1306.
- Micó, E. (2018): Saproxylic insects in tree hollows. In: Ulyshen M (Ed.) Saproxylic Insects. Zoological Monographs Vol. 1. Springer, Cham: 693-727.
- Micó, E., García-López, A., Sánchez, A., Juárez, M., Galante, E. (2015): What can physical, biotic and chemical features of a tree hollow tell us about their associated diversity? Journal of Insect Conservation 19: 141-153.
- Müller, J., Bussler, H., Bense, U., Brustel, H., Flechtner, G., Fowles, A., ..., Zabransky, P. (2005): Urwald relict species - saproxylic beetles indicating structural qualities and habitat tradition. Waldökologie online 2: 106-113.
- Müller, J., Bussler, H., Kneib, T. (2008): Saproxylic beetle assemblages related to silvicultural management intensity and stand structures in a beech forest in Southern Germany. Journal of Insect Conservation 12: 107-124.
- Müller, J., Jarzabek‐Müller, A., Bussler, H., Gossner, M. M. (2014): Hollow beech trees identified as keystone structures for saproxylic beetles by analyses of functional and phylogenetic diversity. Animal Conservation 17: 154-162.
- Müller, J., Brustel, H., Brin, A., Bussler, H., Bouget, C., Obermaier, E., ..., Gossner, M. M. (2015): Increasing temperature may compensate for lower amounts of dead wood in driving richness of saproxylic beetles. Ecography 38: 499-509.
- Ranius, T., Niklasson, M., Berg, N. (2009): Development of tree hollows in pedunculate oak (Quercus robur). Forest Ecology and Management 257: 303-310.
- Schauer, B., Steinbauer, M. J., Vailshery, L. S., Müller, J., Feldhaar, H., Obermaier, E. (2018): Influence of tree hollow characteristics on saproxylic beetle diversity in a managed forest. Biodiversity and Conservation 27: 853-869.
- Schmidl, J., Büche, B. (2018): Die Rote Liste und Gesamtartenliste der Käfer (Coleoptera, exkl. Lauf-und Wasserkäfer) Deutschlands im Überblick (Stand Sept. 2011). Naturschutz und Biologische Vielfalt 70 (in Vorbereitung).
- Seibold, S., Thorn, S. (2018): The importance of dead-wood amount for saproxylic insects and how it interacts with dead-wood diversity and other habitat factors. In: Ulyshen M (Ed.) Saproxylic Insects. Zoological Monographs Vol. 1. Springer, Cham: 607-637.
- Seibold, S., Bässler, C., Brandl, R., Büche, B., Szallies, A., Thorn, S., …, Müller, J. (2016): Microclimate and habitat heterogeneity as the major drivers of beetle diversity in dead wood. Journal of Applied Ecology 53: 934-943.
- Siitonen, J. (2012): Microhabitats. In: Stokland JN, Siitonen J, Jonsson BG (Eds.) Biodiversity in Dead Wood. Cambridge University Press, Cambridge: 150-182.
- Sverdrup-Thygeson, A., Gustafsson, L., Kouki, J. (2014): Spatial and temporal scales relevant for conservation of dead-wood associated species: current status and perspectives. Biodiversity and Conservation 23: 513-535.



