LWF Wissen 87
Die Moorbirke (Betula pubescens Ehrh.) – Verbreitung, Standort und Ökologie
von Markus Engel, Lisa Kaule, Marc Kühnbach, Tobias Mette und Wolfgang Falk
Die Moorbirke (Betula pubescens Ehrh.) ist eine flexible Pionierart mit einem sehr großen Verbreitungsgebiet von Grönland bis nach Sibirien. Als Spezialist für kalt-trockene und kühl-feuchte Klimate der borealen Zone und der hohen Gebirgslagen ist ihr Vorkommen im mediterranen Raum durch Hitze und Trockenheit begrenzt. Die Moorbirke kann saure und vernässte Böden, anmoorige und Moorstandorte tolerieren und kommt mit den ärmsten Bodenbedingungen und Rohböden zurecht. Ihre Zukunft in einem deutlich wärmeren Klima wird durch ihre vergleichsweise geringe Dürreresistenz beeinträchtigt, obwohl einige Provenienzen deutlich besser mit Trockenheit umzugehen wissen. In Europa und Bayern ist und bleibt sie daher ein Spezialist für Sonderstandorte, da sie sich schwer in der Konkurrenz mit anderen Klimax-Baumarten behaupten kann.
Die Verbreitung der Moorbirke
Ihr Verbreitungsschwerpunkt liegt im borealen Raum. Sommerliche Hitze und Trockenheit verhindern ihre Ausbreitung in Südeuropa, sodass sie dort nur in höheren Lagen anzutreffen ist, im Gegensatz zu der verwandten Hängebirke (Betula pendula Roth.), die auch noch in Griechenland und auf der iberischen Halbinsel häufiger vorkommt (Beck et al. 2016). Die ausgeprägte Kältetoleranz (Rinne et al. 1998, Taulavuori et al. 2004) und ihre Fähigkeit, Rohböden als Pionier zu besiedeln (Karlsson & Weih 2001), ermöglichen es der Moorbirke auf sehr kargen Standorten in hohen Lagen bis an die Baumgrenze hinauf zu wachsen und dies sogar weiter als Nadelbaumarten wie Fichte (Picea abies Karst. H.) im selben Gebiet (Truong et al. 2007, Odland 2015, Kullman 2022).
Vegetationsperiode und das Auftreten starker, kalt-trockener Winde begrenzt, wogegen die Moorbirke wenig resistent erscheint (Beck et al. 2016). Nördlich der Baumgrenze bildet die Moorbirke in den ozeanisch beeinflussten subarktischen Arealen Europas sogar noch einen schmalen Birkengürtel (Kallio & Mäkinen 1978). Nach bisherigen Untersuchungen finden sich die nacheiszeitliche Verbreitungszentren der Moorbirke nicht nur in Südeuropa, sondern auch in Nord- Ost-Europa (Oksanen et al. 2001, Väliranta et al. 2011), was vermutlich zur einer schnellen Wiederbesiedlung beigetragen hat.
Die Moorbirke zeigt eine Tendenz zur Hybridisierung mit der Zwergbirke (Betula nana L.) (Karlsdóttir et al. 2009, Kenworthy et al. 2010, Eidesen et al. 2015). Unterarten der Moorbirke wurden in Britannien, speziell in Schottland mit der Subspezies tortuosa aufgeführt (Gardiner 1972, Gardiner 1984, Pelham et al. 1988) und in Skandinavien mit der Subspezies czerepanovii (Taulavuori et al. 2004, Ruotsalainen et al. 2009, Öberg & Kullmann 2012). Nach aktuellem Wissensstand sind diese Unterarten aber lediglich phänotypische Anpassungen an die spezifischen Umweltbedingungen des Vorkommensgebietes der sehr variantenreichen Moorbirke (vgl. Beitrag G. Aas in diesem Band).
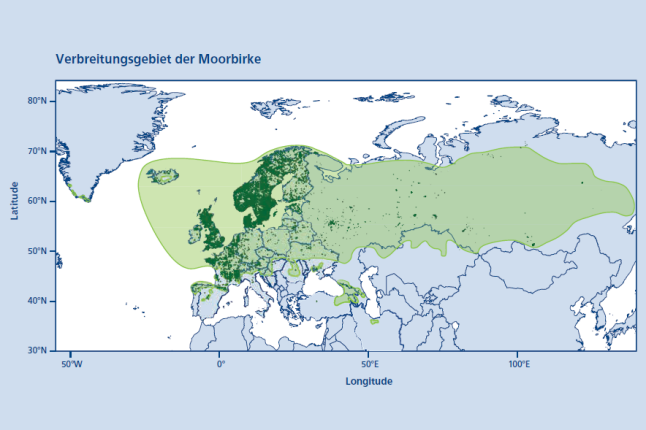
Abb. 1: Verbreitungsgebiet der Moorbirke (Betula pubescens Ehrh.). Punkte zeigen die Vorkommen von 1980 – 2022 aus GBIF (2023). Das Verbreitungspolygon zeigt das Vorkommen nach der Chorologischen Karte aus Caudullo et al. (2018). (© LWF)
Die Ökologie der Moorbirke
Wichtig zum Verständnis der Reaktion der Moorbirke auf Bodenbedingungen ist das Wurzelsystem. Dieses ist herzförmig (Kreutzer 1961), bildet bis zu 25 m laterale Ausläufer im Oberboden und bis zu 3m Tiefe Senker in den Unterboden (Atkinson 1992). Die Durchwurzelung ist sehr plastisch und kann sich an verschiedenste Bodenbedingungen anpassen (Perala & Alm 1990), was ihren Pioniercharakter unterstützt. Auf flachen Böden oder Böden mit hochanstehendem Grund- oder Stauwasser kann sich ein sehr flaches Wurzelsystem als Reaktion bilden, was die Windwurfgefahr erhöht (Rau 1988).
Die Moorbirke besitzt nur ein geringes Vermögen, die Transpiration über ihre Stomata während einer Dürre zu regulieren, weshalb sie im Gegensatz zur Stieleiche (Quercus robur L.), als weniger Dürreresistent gilt (Beerling et al. 1996). Dies zeigte auch ein Gewächshausexperiment mit Sämlingen der Moorbirke (Lanta & Hazuková 2005). Betrachtet man die Vorkommen der Moorbirke in Europa, so lässt sich eine scharfe Grenze im warm-trockenen Bereich erkennen (Abbildung 2). Trotz ihrer geringen Kontrolle der Transpiration besitzt die Moorbirke dennoch die Fähigkeit kalt-trockenen Winterperioden zu trotzen, indem sie zur Erhaltung der Stoffwechselvorgänge bestimmte Proteine in ihrem Gewebe (z. B. Knospen) anreichert (Rinne et al. 1999).
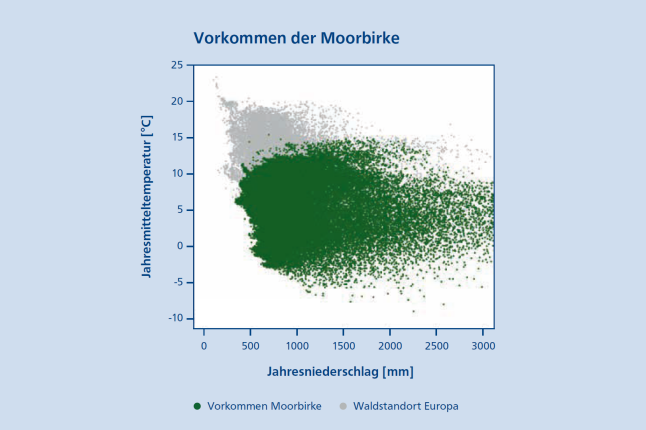
Abb. 2: Das Vorkommen der Moorbirke (Betula pubescens Ehrh.) in Europa (grün) nach Jahresniederschlag [mm] und Jahresmitteltemperatur [°C] im Vergleich zu weiteren Waldstandorten (grau) nach Buchhorn et al. (2019). Vorkommensdaten beruhen auf Mauri et al. (2017), Caudullo et al. (2018) und GBIF (2023). (© LWF)
Die Zukunft der Moorbirke im Klimawandel
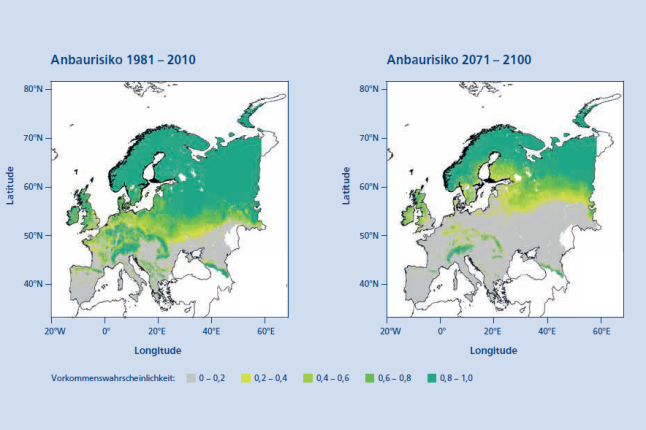
Abb. 3: Das Anbaurisiko der Moorbirke (Betula pubescens Ehrh.) in Europa für die Periode 1981 – 2010 (links) und für die Periode 2071 – 2100 (rechts) unter Anwendung eines RCP 8.5 Szenarios. (© LWF)
Die Moorbirke
Die Moorbirke bietet sich wie kaum eine andere Baumart an, um einen der wichtigsten Faktoren für die Verbreitung von Baumarten zu diskutieren, die Kältetoleranz. Die Kältegrenze der Moorbirke liegt zwar weit außerhalb Mitteleuropas in der Winterhärtezone 1 (nach Heinze und Schreiber 1984), d. h. sie hält Temperaturen unter – 45.5 °C aus. Aber die prinzipiellen Mechanismen der Anpassung an eine saisonale Frostperiode sind übertragbar. Auch unsere Buche muss in Winterhärtezone 5 Temperaturen von bis zu – 30 °C überleben. Ein erster offensichtlicher Anpassungsmechanismus vor allem der temperaten und borealen Laubbaumvertreter ist ganz offensichtlich der Blattabwurf. Damit wird eine Schädigung dieses wichtigen Organs von vornherein vermieden. Immergrüne Nadelbäume wie Fichten, Tannen oder Kiefern müssen kostenintensive Kompromisse in Blattaufbau und -physiologie eingehen, um das Überleben ihres Nadelkleids im Winter zu sichern. In Ostsibirien, wo die Temperaturen auf unter – 70 °C fallen können, wird die Waldgrenze schließlich sogar von einer laubwerfenden Nadelbaumart, der sibirischen Lärche, gebildet. Doch der Laubabwurf bringt auch Nachteile mit sich: (1) Wärmere Tage in den Übergangsjahreszeiten können nicht zur Fotosynthese genutzt werden, und (2) mit dem Blattabwurf gehen auch Nährstoffe verloren, deren Umsetzung unter den gegebenen Klimabedingungen nur sehr langsam erfolgt. Betula pubescens war hierbei vielfach Studienobjekt, besonders hinsichtlich des Laubaustriebs im Frühjahr als auch der Abhärtung der Knospen im Herbst und der Steuerung dieser Prozesse in Abhängigkeit der Fotoperiode und Temperatur (e.g. Caffarra et al. 2011), verschiedener Herkünfte (e.g. Taulavuori et al. 2004), bis hin zum molekularbiologischen Verständnis (e.g. Welling et al. 2004). Neben dem Fokus auf die Assimilationsorgane zeichnen sich boreale Laubbaumarten durch weitere Merkmale aus: hohe Lichtbedürftigkeit, lockere Krone, geringe Stammzahl, niedriges Holzgewicht, leichte windverbreitete Samen. Interessant, dass jene Eigenschaften, die Birken, Pappeln oder Weiden bei uns zu konkurrenzschwachen Pionierarten machen, diesen Arten erst das Überleben in der Borealis ermöglichen.
Lit.-Empfehlung: Matyssek et al. 2010, Kap. 4.7; Barnes et al. 1997, Kap. 9; Larcher 2001, Kap. 6.2.2; Archibold 2012, Kap. 8.
Literatur
- Archibold, O.W. (2012): Ecology of world vegetation. Springer Science & Business Media.
- Atkinson, M.D. (1992): Betula pendula Roth (B. verrucosa Ehrh.) and B. pubescens Ehrh. – Biological Flora of the British Isles. Journal of Ecology 80: 837-870.
- Barnes, B.V.; Zak, D.R.; Denton, S.R.; Spurr, S.H. (1997): Forest ecology (No. Ed. 4). John Wiley and Sons.
- Beck, P.; Caudullo, G.; de Rigo, D.; Tinner, W. (2016): Betula pen- dula, Betua pubescens and other birches in Europe: distribu- tion, habitat, usage and threats. In: San-Miguel-Ayanz, J., de Rigo, D., Caudullo, G., Houston Durrant, T., Mauri, A. (Eds.), European Atlas of Forest Tree Species. Publ. Off. EU, Luxem- bourg, pp. e010226+.
- Beerling, D.J.; Heath, J.; Woodward, F.I.; Mansfield, T.A. (1996): Drought-CO2 interactions in trees: observations and mechanis- ms. New Phytologist 134: 235-242.
- Buchorn, M.; Smets, B.; Bertels, L.; De Roo, B.; Lesiv, M.; Tsendba- zar, N.-E.; Herold, M.; Fritz, S. (2019): Copernicus Global Land Service Cover 100m: collection 3: epoch 2019: Globe.
- Caffarra, A.; Donnelly, A.; Chuine, I.; Jones, M.B. (2011): Model- ling the timing of Betula pubescens budburst. I. Temperature and photoperiod: a conceptual model. Climate Research, 46(2), 147-157.
- Caudullo, G.; Welk, E.; San-Miguel-Ayanz, J. (2018): Betula pub- escens chorology. figshare. Dataset. https://doi.org/10.6084/ m9.figshare.5100769.v4
- Čížková, H.; Květ, J.; Comín, F.A.; Laiho, R.; Pokorný, J.; Pithart, D. (2013): Actual state of European wetlands and their possible future in the context of global climate change. Aquat Sci.75: 3-26.
- Eidesen, P.B.; Alsos, I.G.; Brochmann, C. (2015): Comparative analysis of plasmid and AFLP data suggest different coloni- zation history and asymmetric hybridization between Betula pubescens and B. nana. Molecular Ecology 24: 3993-4009.
- Ellenberg, H.; Weber, H.E.; Düll, R.; Wirth, V.; Werner, W.; Paulißen, D. (1992): Zeigerwerte von Pflanzen in Mitteleuropa. Scripta Geobotanica 18 (2. Auflage 1992).
- Erlendsson, E.; Edwards, K.J. (2009): The timing and causes of the final pre-settlement expansion of Betula pubescens in Ice- land. The Holocene 19(7): 1083-1091.
- Fredskild, B. (1991): The genus Betula in Greenland - Holocene history, present distribution and synecology. Nordic Journal of Botany 11: 393-412.
- Gardiner, A.S. (1972): A review of the sub-species carpatica and tortuosa within the species Betula pubescens Ehrh. Transac- tions of the Botanical Society of Edinburgh 41(4): 451-459.
- Gardiner, A.S. (1984): Taxonomy of intraspecific variation in Betula pubescens Ehrh., with particular reference to the Scot- tish Highlands. Proceedings of the Royal Society of Edinburgh 85B: 13-26.
- Grodetskaya, T.; Evlakov, P.; Padutov, V. (2020): The effect of drought on the expression of stress resistance genes in per- spective forms of birch. IOP Conf. Series: Earth and Environmental Science 595: 012039.
- GBIF.org (10 February 2023): GBIF Occurrence Download https://doi.org/10.15468/dl.77muzy.
- Hannus, S; Hirons, A.; Baxter, T.; McAllister, H.A.; Wiström, B.; Sjöman, H. (2021): Intraspecific drought tolerance of Betula pendula genotypes: an evaluation using leaf turgor loss in a botanical collection. Trees 35: 569-581.
- Isakov, Y. (2021): The effect of a single inbreeding on the growth and development of fast-growing tree species, Betula pendula and Betula pubescens. IOP Conf. Series: Earth and Environmental Science 875: 012014.
- Kallio, P.; Mäkinen, Y. (1978): Vascular Flora of Inari Lapland. 4. Betulaceae. Reports Kevo Subarctic Research Station 14, 38-63.
- Karger, D.N.; Schmatz, D.; Detttling, D.; Zimmermann, N.E. (2020): High resolution monthly precipitation and temperature time- series for the period 2006-2100. Scientific Data 7: 248.
- Karlsdóttir, L.; Hallsdóttir, M.; Thórsson, A.T.; Anamthawat-Jóns- son, K. (2009): Evidence of hybridization between Betula pu- bescens and B. nana in Iceland during the early Holocene. Review of Paleobotany and Palynology 156: 350-357.
- Karlsson, P.S.; Weih, M. (2001): Soil temperatures near the dis- tribution limit of the Mountain Birch (Betula pubescens ssp. czerepanovii): Implications for seedling nitrogen economy and survival. Artic, Antartic, and Alpine research 33(1): 88-92.
- Kenworthy, J.B.; Aston, D.; Bucknall, S.A. (1972): A study of hyb- rids between Betula pubescens Ehrh. And Betula nana L. from Sutherland - an integrate approach. Transactions of the Botanical Society of Edinburgh 41(4): 517-539.
- Kolb, E.; Mellert, K.-H.; Göttlein, A. (2019): Soil nutrient status of natural soils in Europe. Landscape Research and Nature Protection 18: 5-13.
- Kreutzer, K. (1961): Wurzelbildung junger Waldbäume aus Pseudoglyen. Forstwissenschaftliches Centralblatt 80: 356-392.
- Kullman, L. (2022): Forest-Limit (Betula pubescens ssp. czere- panovii) performance in the context of gentle modern climate warming. European Journal of Applied Sciences 10(3): 168-185.
- Kuivinen, K.C.; Lawson, M.P. (1982): Dendroclimatic analysis of birch in South Greenland. Arctic and Alpine Research 14(3): 243-250.
- Lanta, V.; Hazuková, I. (2005): Growth response if downy birch (Betula pubescens) to moisture treatment at a cut-over peat bog in the Šumava Mts., Czech Republic. Annales Botanici Fennici 42: 247-256.
- Larcher, W. ed. (2001): Ökophysiologie der Pflanzen. 6. Auflage, Ulmer Verlag, Stuttgart
- Mauri, A.; Strona, G.; San-Miguel-Ayanz, J. (2017): EU-Forest, a high-resolution tree occurrence dataset for Europe. Scientific Data 4: 160123.
- Matyssek, R.; Fromm, J.; Rennenberg, H.; Roloff, A. (2010): Bio- logie der Bäume: von der Zelle zur globalen Ebene (Vol. 8450). UTB.
- Nieuwenhuis, N.; Barrett, F. (2002): The growth and potential of downy birch (Betula pubescens (Ehrh.)) in Ireland. Forestry 75(1): 75-87.
- Odland, A. (2015): Effect of latitude and mountain height on the timberline (Betula pubescens ssp. czerepanovii) eleva- tion along the central Scandinavian mountain range. Fennia 193(2): 260-270.
- Öberg, L.; Kullman, L. (2012): Contrasting short-term performan- ce of mountain birch (Betula pubescens ssp. czerepanovii) treeline along a latitudinal continentality-maritimity gradient in the southern Swedish Scandes. Fennia 190(1): 19-40.
- Oksanen, P.O.; Kuhry, P.; Alekseeva, R.N. (2001): Holocene de- velopment of the Rogovaya river plateau, European Russian Arctic. The Holocene 11(1): 25-40.
- Pelham, J.; Gardiner, A.S.; Smith, R.I.; Last, F.T. (1988): Variation in Betula pubescens Ehrh. (Betulaceae) in Scotland: its nature and association with environmental factors. Botanical Journal of the Linnean Society 96: 217-234.
- Perala, D.A.; Alm, A.A. (1990): Reproductive ecology of birch.: a review. Forest Ecology and Management 32: 1-38.
- Rau, H.-M. (1988): Nachkommenschaften in- und ausländischer Birken für problematische Standorte in der Bundesrepublik Deutschland. Holzzucht 42: 11-17.
- Rinne, P.; Welling, A.; Kaikirania, P. (1998): Onset of freezing tolerance in birch (Betula pubescens Ehrh.) involves LEA pro- teins and osmoregulation and is impaired in an ABA-deficient genotype. Plant, Cell and Environment 21: 601-611.
- Rinne, P.L.H.; Kaikuranta, P.L.M.; van der Plas, L.H.W.; van der Schoot, C. (1999): Dehydrins in cold-acclimated apices of birch (Betula pubescens Ehrh.): production, localization and potential role in rescuing enzyme function during dehydration. Planta 209: 377-388.
- Roloff, A.; Weisgerber, H.; Lang, J.U.; Stimm, B.; Schütt, P. (2009): Enzyklopädie der Holzgewächse: Handbuch und Atlas der Dendrologie. Wiley-VCH Verlag GmbH & Co. KGaA; 1. Auflage, 5820 S.
- Ruotsalainen, A.L.; Markkola, A.M.; Kozlov, M.V. (2009): My- corrhizal colonization of mountain birch (Betula pubescens ssp. czerepanovii) along three environmental gradients: does life in harsh environments alter plant-fungal relationships? En- vironmental Monitoring and Assessment 148: 215-232.
- Taulavuori, K.M.; Taulavuori, E.B.; Skre, O.; Nilsen, J.; Igeland, B.; Laine, K.M. (2004): Dehardening of mountain birch (Betula pu- bescens ssp. czerepanovii) ecotypes at elevated winter temperatures. New Phytologist 162: 427-436.
- Teepe, R.; Dilling, H., Beese, F. (2003): Estimating water retention curves of forest soils from soil texture and bulk density. Journal of Plant Nutrition and Soil Science 166(1): 111 - 119.
- Truong, C.; Palme, A.E.; Felber, F. (2007): Recent invasion of the mountain birch Betula pubescens ssp. tortuosa above the treeline due to climate change: genetic and ecological study in northern Sweden. Journal of Evolutionary Biology 20(1): 369 - 380.
- Väliranta, M.; Kaakinen, A.; Kuhry, P.; Kultti, S.; Salonen, J.S.; Seppä, H. (2011): Scattered late-glacial and early Holocene tree populations as dispersal nuclei for forest development in north-eastern European Russia. Journal of Biogeography 38: 922 - 932.
- Welling, A.; Rinne, P.; Viherä-Aarnio, A.; Kontunen-Soppela, S.; Heino, P.; Palva, E.T. (2004): Photoperiod and temperature diff erentially regulate the expression of two dehydrin genes during overwintering of birch (Betula pubescens Ehrh.). Journal of Experimental Botany 55(396): 507 - 516.



