LWF Wissen 87
Moorbirke – Saatgut, Genetik und Herkunftsempfehlungen
von Muhidin Šeho, Jonas Eckel und Barbara Fussi
Die Moorbirke (Betula pubescens EHRH.) ist eine Pionierbaumart und hat ein großes natürliches Verbreitungsgebiet, welches mit dem Verbreitungsgebiet der Sandbirke (Betula pendula jj ROTH) vergleichbar ist. Es reicht jedoch weiter in den Osten und Norden. Im Mittelmeerraum kommt die Moorbirke hingegen nicht vor (Abbildung 1). In den nördlichen Ländern kann die Moorbirke an der alpinen Baumgrenze vorkommen. Die Ansprüche an Klima und Boden sind sehr gering. Sie benötigt mehr Wasser als die Sandbirke und verträgt keine langen Trockenperioden. In Bayern weist die Moorbirke Verbreitungsschwerpunkte im Bayerischen Wald, im Frankenwald und dem Fichtelgebirge, den Bayerischen Alpen und im Alpenvorland sowie im Fränkischen Keuper, der Frankenalb, dem Oberpfälzer Jura und im Tertiären Hügelland auf. Moorbirke und Sandbirke überschneiden sich in ihren Standortsansprüchen und kommen z. B. auf oberflächig entwässerten Mooren in denselben Beständen vor (Atkinson 1992, Wagner 1994). Die Moorbirke stockt in erster Linie auf mineralischen, oft allerdings anmoorigen Feuchtstandorten in sauren Brüchen, Moorrandgebieten und am Rand von Blockhalden. Bisher war die Art Moorbirke in Mitteleuropa zumindest mit zwei Unterarten, u. a.: 1) B. pubescens EHRH. ssp. pubescens (Hegi 1981) und 2) B. pubescens EHRH. ssp. carpatica (Waldst. et Kit.) ASCHERS. et GRAEBN (u.a. Hampe 1973: Flora Hercynica) beschrieben. Letztere ist nach Wagner 1994 vermutlich aus Kreuzungen mit Betula nana entstanden. Sowohl die sehr variable Morphologie der Moorbirke als auch die geografische Verbreitung und die ökologische Einnischung lässt keine klare Abgrenzung gegenüber der Moorbirke und ihre intraspezifische Gliederung (Hibsch-Jetter 1997, Kuneš et al. 2019) zu. Aus diesem Grund gilt die Karpatenbirke aktuell nicht als eigene Art oder Unterart (Ashburner und McAllister 2013). Morphologisch zeichnet sich die typische Moorbirke durch behaarte Blätter und Triebe aus. Genetisch lassen sich die beiden Birkenarten (Betula pubescens und Betula pendula) anhand ihrer verschiedenen Chromosomensätze/-zahlen eindeutig unterscheiden (Brown und Williams 1984). Hybridisierungen werden beschrieben, sind jedoch selten. Bundesweit ist die Moorbirke laut der Roten Liste zwar nicht gefährdet, wohl aber werden Moorbirken-Wälder nach neuerer Literatur als (sehr) stark gefährdet betrachtet (BayLfU/165/2003). Die Moorbirke ist als eine typische Art der Moore eine ökologisch wichtige Baumart, die einen wichtigen Beitrag zum Schutz von Wassereinzugsgebieten und Bodenstabilisierung leistet und die Biodiversität von Vögeln und Insekten stärkt. Im Klimawandel nehmen die Moore eine bedeutende Rolle für die Bindung von CO2 ein und bieten einen wichtigen Lebensraum für seltene heimische Arten. Durch Maßnahmen der Moorrenaturierung wird ein steigender Bedarf an hochwertigem und geeignetem Saat- und Pflanzgut erwartet.
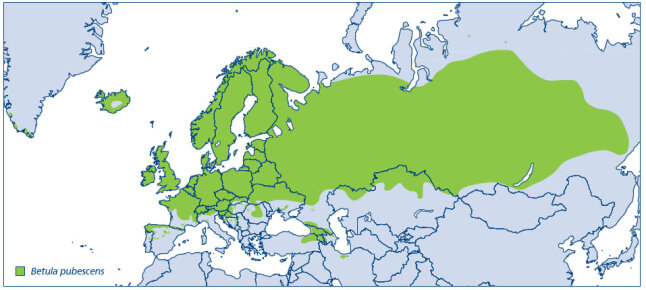
Abb. 1: Das natürliche Verbreitungsgebiet der Moorbirke nach Caudullo et al. 2017
Saatgut und Vermehrung
In der Literatur werden Angaben nur teilweise artspezifisch (d.h. nur bezogen auf die Moorbirke) gemacht. Immer wieder werden Aussagen auf Gattungsebene (Betula spec.) getroffen (Perala und Alm 1990, Schubert 1998). Dies macht es schwierig, sauber zwischen Aussagen zu trennen, die nur für die Moorbirke gelten und solchen die für die Gattung Betula insgesamt oder wenigstens für die bei uns (wirtschaftlich) relevanten Arten (Moor- und Sandbirke) zutreffen. Der gesamte Prozess von der Ernte über die Saatgutaufbereitung, die Lagerung, Testung und Aussaat in der Baumschule ist für die Moor- und für die Sandbirke gleich, mit der Ausnahme der geringfügig späteren Ernte bei der Moorbirke (Suszka et al. 1994).
Fruktifikation, Samenreife und Ernte
Die Moorbirke ist eine einhäusige, getrenntgeschlechtliche sowie windbestäubte Baumart (Suszka et al. 1994). In seltenen Fällen kommen auch sterile, nur weibliche oder männliche Individuen sowie zwittrige Blüten vor (Dellinghausen und Stern 1958). Nach Longman (1984) beginnen Moorbirken im Regelfall im Alter von fünf bis zehn Jahren zu blühen. Perala und Alm (1990) nennen ein Alter von 10 bis 15 Jahren, ab dem die Birken fruktifizieren. Nach Suska et al. (1994) beginnt die Fruktifikation mit 15 Jahren im Freistand, im dichten Bestand verläuft diese jedoch später. Birken fruktifizieren häufig, nach Perala und Alm (1990) jährlich und alle drei Jahre besonders stark, nach Ludwig (2023) alle ein bis drei Jahre mit starken jährlichen Schwankungen und oft nur schwach (Sprengmast). Vollmasten kommen ihm zufolge lediglich alle fünf bis sechs Jahre vor. Betula pubescens beginnt etwas später (ca. eine Woche) im Jahr zu blühen als Betula pendula, (Scholz 1972, Suszka et al. 1994). Der Pollenflug findet je nach Breitengrad zwischen Mitte März und Ende Mai statt (Johnssohn 1974, Scholz 1972). Die Pollen der Moorbirke fliegen dabei bis zu 2000 km weit (Hjelmroos 1991). Nach der Blüte entwickeln sich die weiblichen Kätzchen bzw. Blüten weiter zu Fruchtständen und die männlichen Kätzchen fallen zu Boden (Suszka et al. 1994). Die Samenreife tritt bei der Birke ab Mitte Juli ein (Ludwig 2023, Schönborn 1964), wobei die Fruchtstände der Moorbirke später als die der Sandbirke reif werden, im Allgemeinen im Zeitraum August-September (Suszka et al. 1994). Der Samenfall findet mehrheitlich dann im September und Oktober statt (Perala und Alm 1990). Anders als die Pollen gehen die Samen aber größtenteils in einem Umkreis von nur 100 m um den Mutterbaum zu Boden (Perala und Alm 1990). Neben der Verbreitung durch den Wind können Birken-Samen auch auf der Wasseroberfläche von Bächen und Flüssen schwimmend verbreitet werden (Suska et al. 1994). Der Erntezeitraum für Birkensamen sind der Juli und der August, v. a. aber Mitte Juli bis Mitte August (Burkhart 2018, Ludwig 2023). Die Kätzchen sollten zum Erntezeitpunkt noch grün bzw. nicht voll ausgereift sein, da sie sonst bei der Ernte zerfallen und die Samen verloren gehen (Morgenthaler 1915). Da die Samen oft aber nicht gleichzeitig reif werden, kann eine wiederholte Beerntung nötig sein (Schönborn 1964). Die Ernte erfolgt am stehenden Baum über ausgelegten Kunststoffplanen oder Netzen durch Abklopfen der Zweige mit Stangen oder Herunterrütteln der Samen mittels Baumrüttler (Burkhart 2018, Ludwig 2023). Auch das Abschneiden von Ästen ist mitunter eine Möglichkeit (Burkhart 2018).

Abb. 2: Starke Moorbirke im Saatguterntebestand bei Benediktbeuern. (© M. Šeho)
Saatgutaufbereitung und -lagerung
Unmittelbar nach der Ernte im Wald / auf der Samenplantage wird das Rohsaatgut für ein bis drei Wochen in ein kühles (höchstens 25 °C), schattiges und luftiges Zwischenlager zur Nachreife bzw. Vortrocknung verbracht. Während der Nachreife sollte es immer zwei- bis dreimal Mal pro Woche umgeschaufelt werden. Im Anschluss an die Nachreife wird das Rohsaatgut mittels Rüttelsiebe und ggf. Steigsichter gereinigt. Die Kätzchen zerfallen dabei ähnlich den Tannen-Zapfen in Samen und Schuppen und werden voneinander getrennt (Burkhart 2018, Ludwig 2023, Reiss 2023). Vor der Einlagerung ist schließlich auch die Trocknung des Saatgutes notwendig (mit oder auch ohne die Einstellung eines bestimmten Wassergehaltes) (Schön-born 1964, Reiss 2023). Birken-Saatgut verträgt eine sehr starke Austrocknung und extreme Kälte. Dies gilt sowohl für die Sandbirke als auch für die Moorbirke. Die Kälte-Unempfindlichkeit des Saatgutes nimmt dabei mit sinkendem Wassergehalt sogar noch zu. Bei 16 % Wassergehalt werden ohne Probleme – 70 °C ertragen, dies ergab ein sechsmonatiger Lagerversuch. Sogar eine Trocknung auf nahezu 0 % Wassergehalt übersteht das Saatgut ohne Schaden, jedoch wurden nach trockener Lagerung des Öfteren Keimhemmungen festgestellt, die vor einer Keimung erst wieder überwunden werden müssen. Bei einer eher kurzen Lagerung von ein bis zwei Jahren ist daher ein höherer Samen-Wassergehalt von 16 % überlegenswert. In Versuchen führten eine Temperatur von – 10 °C und ein Wassergehalt von 10 bzw. 16 % zudem zur Erhöhung der Keimkraft (Schönborn 1964). Die Lagerung der Birkensamen, insbesondere die mehrjährige, sollte in einem luftdichten Behältnis (Glas- oder Kunststoffbehälter / Foliensack) erfolgen. Der Wassergehalt sollte je nach Autor von 5 – 10 % liegen. Die angegebenen Lagertemperaturen liegen im Bereich von 0 °C bis – 10 °C und die Länge der Lagerfähigkeit bei drei bis zehn Jahren (Burkhart 2018, Ludwig 2023, Schönborn 1964, Schubert 1998). Tiefere Lagertemperaturen als – 10 °C sind nach Schönborn (1964) aber auch möglich. Schubert (1998) empfiehlt Saatgut, welches längerfristig gelagert werden soll, möglichst spät zu ernten (»nach der Gelbbraunverfärbung bis zur beginnenden Gefügelockerung der Zäpfchen«). Geerntetes Saatgut soll außerdem schnell getrocknet und aufbereitet werden. Schönborn (1964) hält für eine langfristige Lagerung auch eine sehr konstante Lagertemperatur und Feuchtigkeit des Saatgutes für notwendig.
Saatgutqualität, Stratifikation und Anzucht
Die Qualität des Birkensaatgutes, insbesondere die Keimfähigkeit, schwankt stark in Abhängigkeit vom Fruktifikationsgeschehen des jeweiligen Erntejahres, der Witterung während des Pollenflugs, der Saatgutpartie und der Saatgutbehandlung (Jenner 2023, Ludwig 2023, Reiss 2023, Burkart 2018, Schubert 1998). Vollmasten lassen bessere Saatgutqualitäten erwarten (Reiss 2023, Burkart 2018). 100 kg Moorbirken-Fruchtstände enthalten nach Suska et al. (1994) 15 kg Samen und nach Burkhart (2018) zwischen 13 und 28 kg. Ein Kilogramm Saatgut (Samen mit Schuppen) enthält nach Suska et al. (1994) im Durchschnitt 3,9 Millionen Samen und reines Saatgut (ohne Schuppen) 8,3 Millionen Samenkörner pro Kilogramm, sodass sich daraus ein Tausendkorngewicht von 0,12 g ergibt. Nach Burkhart (2018) liegt das Tausendkorngewicht der reinen Moorbirken-Samen (d. h. ohne Schuppen), bei 0,2 bis 0,3 g, sodass ein Kilogramm Samen ca. drei bis fünf Millionen Einzelsamen enthält. Die Keimfähigkeit wird bei der Birke meist nicht als Keimprozent bestimmt, sondern nach der ISTA-konformen Methode der gewogenen Wiederholungen (ISTA 2020). In der AWG-Genbank eingelagerte sowie weitere, am AWG geprüfte Saatgutpartien der Moorbirke, zeigten Keimprozente von 20 bis 100 %, wogegen Burkhart (2018) Keimprozente von bis zu 10 % nennt. Bei den lebenden Keimen wurden vom AWG-Saatgutlabor zwischen 175.000 und 1.100.000 lebende Samen pro Kilogramm Moorbirken-Saatgut ermittelt (Jenner 2023). Mit zunehmender Lagerdauer kann die Anzahl lebender Samen pro kg aber mehr oder weniger stark zurückgehen. Die älteste Genbank-Partie weist nach 30 Jahren Lagerdauer immerhin noch 425.000 keimfähige Samen pro kg auf (entspricht einem Keimprozent von ca. 14 %). Ludwig (2023) nennt Zahlen von 900.000 bis 1.300.000 keimfähige Samen pro Kilogramm Saatgut. Bei einem Keimprozent von bis zu 10 % können daraus 300.000 – 500.000 Sämlinge angezogen werden (Burkart 2018).
Nach Perala und Alm (1990) enthält die Schale der Birkensamen einen Keimhemmer, welcher jedoch durch Stratifizierung oder Licht ausgeschaltet werden kann. Auch Suszka et al. (1994) schreibt, dass die Keimhemmung der Moorbirke durch eine kurze Bescheinung mit schwachem Licht gebrochen werden kann. Im Freiland (Baumschule, Wald) reicht ihm zufolge dafür das Tageslicht. Burkhart (2018) und Reiss (2023) zufolge ist eine Stratifikation des Saatgutes vor der Aussaat nicht erforderlich. Auf der reinen Laubstreu keimen die Birkensamen jedoch schlecht, gut hingegen auf einer Mischung aus Mineralboden und Humus. Auch Ludwig (2023) weist darauf hin, dass für die Freisaat ein freigelegter Mineralboden notwendig ist. Nach Perala und Alm (1990) können Birkensamen allerdings auch auf Torfboden oder Torfmoosen keimen. Gute Anwuchsbedingungen unmittelbar nach der Keimung sind gerade bei den sehr kleinen Samen der Birke wichtig, da sie nur wenig Reservestoffe haben (LWF 2017). Eine sogenannte »Schneesaat« ist gegen Ende des Winters (Februar /März), wenn der Schnee schmilzt, möglich. Bei plätzeweiser Ausbringungen werden ca. 2 kg Saatgut pro Hektar benötigt (Ludwig 2023). Die LWF (2017) nennt einen Saatgutbedarf von 0,5 – 4 kg/ha bei der Freisaat im Wald. Rohmeder (1950) nennt für die Bestandesbegründung durch Saat, je nach Bodenzustand und Saatgut-Qualität, eine erforderliche Saatgutmenge von sogar 5 kg bis über 10 kg pro Hektar. Je besser der Bodenzustand und die Saatgut-Qualität, desto weniger Saatgut wird aber benötigt. Gesät werden kann vom Frühherbst bis ins Frühjahr. Für Mitteleuropa war bisher der September der beste Zeitpunkt (Rohmeder 1950). In der Baumschule findet die Frühjahrssaat Ende April /Anfang Mai statt. Vor der Aussaat wird das Saatgut 12 Stunden lang vorgequellt und anschließend wieder so weit getrocknet, dass es wieder rieselfähig ist. Nach der Aussaat werden die Samen mit einer sehr dünnen Schicht Quarzsand bedeckt und der Boden kontinuierlich feucht gehalten. Zum Schutz vor Witterung werden Schattiernetze installiert (Ludwig 2023). Als Sortimente werden sowohl einjährige Sämlinge (1 + 0, 15 – 30 cm oder 30 – 50 cm), als auch zwei- und dreijährige (1 + 1, 50 – 80 cm oder 80 – 120 cm; 1 + 2, bis 150 – 180 cm), verschulte Pflanzen produziert (Burkhart 2018, Ludwig 2023). Ein schonender Transport und eine schonende Lagerung sowie eine sorgfältige Pflanzweise sind für einen guten Anwuchserfolg der Birken-Pflanzung wichtig (Ludwig 2023).
Nutzung forstlicher Genressourcen
In Deutschland werden für die Moorbirke nach dem FoVG vier Herkunftsgebiete ausgewiesen. Das zugelassenes Ausgangsmaterial wird in Tabelle 1 dargestellt. In Bayern sind die Herkunftsgebiete »Südostdeutsches Hügel- und Bergland« und »West- und Süddeutsches Bergland sowie Alpen und Alpenvorland« relevant. Die beiden bayerischen Saatguterntebestände wurden im HKG 805 04 ausgewählt und zugelassen. Daneben hatte das AWG bis 2016 eine geprüfte Samenplantage betrieben, die altersbedingt aufgegeben werden musste. Die neu begründete Samenplantage hat noch keine Zulassung. Die seit 2003 geernteten Mengen an gereinigtem Saatgut werden in Tabelle 2 dargestellt. In den neuen Herkunfts- und Verwendungsempfehlungen wird neben ausgewählten Saatguterntebeständen hochwertiges Saat- und Pflanzgut aus Samenplantagen der Saatgutkategorie geprüft und qualifiziert empfohlen (Tabelle 3). Dieses hochwertige Saatgut stammt aus Samenplantagen und sollte prioritär verwendet werden. Zurzeit werden in beiden Herkunftsgebieten Samenplantagen aus Hessen und Niedersachsen empfohlen. Dieses Saat- und Pflanzgut hat sich auf vielen Standorten als überdurchschnittlich erwiesen (Kleinschmit et al. 1982, 1983, Rau 1991, Steiner et al. 2003).
Tabelle1: Zugelassenes Ausgangsmaterial der Moorbirke nach Herkunftsgebieten (BLE, Abfrage 2022)| HKG | Herkunftsgebiet | Anzahl Bestände | Red. Fläche (ha) | Anzahl zug. Samenplantagen | Red. Fläche |
|---|
| 01 | Norddeutsches Tiefland | 3 | 5,8 | | |
| 02 | Mittel- und Ostdeutsches Tief- und Hügelland | 5 | 15,2 | 1 | 0,4 |
| 03 | Südostdeutsches Hügel- und Bergland | 2 | 2,2 | | |
| 04 | West- und Süddeutsches Bergland sowie Alpen und Alpenvorland | 8 | 33,0 | 6 | 5,2 |
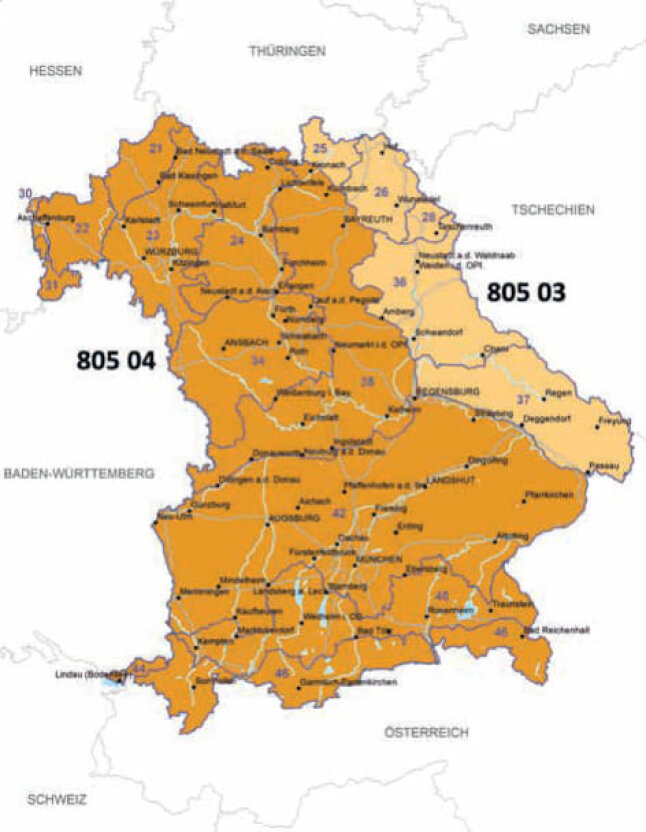
Abb. 3: Herkunftsgebietskarte der Moorbirke in Bayern. Karte: AWG
Beprobte Samenplantagen und Bestände
Samenplantage »Laufen-Lebenau-II«
 Zoombild vorhanden
Zoombild vorhanden
Abb. 4: Weibliche Blütenkätzchen am Ast der Moorbirke auf der Samenplantage Laufen-Lebenau. (© AWG)
Die Moorbirken-Samenplantage »Laufen-Lebenau-II« wurde 2009 als Klon-Samenplantage angelegt und besitzt eine Fläche von einem Hektar. Sie beinhaltet nach aktuellem Stand 31 Klone aus dem Herkunftsgebiet 805 03 (Südostdeutsches Hügel- und Bergland). Sie soll langfristig die altersbedingt 2016 aufgelöste Samenplantage »Laufen-Lebenau-I« ersetzen. Die aufgelöste Samenplantage war stark nachgefragt und wurde nach der Zulassung im Jahr 2003 fast jährlich beerntet. Ein großer Teil der Klone der neuen Samenplantage stammt auch noch von der alten Samenplantage. Um die Klonzahl zu erhöhen, wurden 2012 aber auch neue Plusbäume ausgewählt und abgepfropft. Als Samenplantage dient »Laufen-Lebenau-II« zukünftig der Produktion von hochwertigem, genetisch vielfältigem Saatgut der Moorbirke. Während die Moorbirke an ihren natürlichen Standorten auf Grund der Nässe, der fehlenden Erschließung oder eines dichten Unterstandes teilweise schwierig zu beernten ist, bietet eine Samenplantage beste Voraussetzungen für eine effiziente Saatguternte: eine maschinenbefahrbare Fläche ohne hinderlichen Unterstand mit zahlreichen, kompakt beieinanderstehenden, großkronigen Erntebäumen. Durch die Abpfropfung von ausgewählten Plus-bäumen in verschiedenen Waldbeständen im Zuge der Plantagenanlage beherbergt eine Samenplantage gegenüber einem einzelnen Erntebestand, bei dem in der Regel 10 – 20 Bäume beerntet werden, aus dem gleichen Herkunftsgebiet regelmäßig einen breiteren Genpool und trägt so, über das Saatgut und die Pflanzennachzucht, zum Erhalt der genetischen Vielfalt der Moorbirke bei. Durch Qualitätsauslese bei der Plusbaumauswahl ist oft auch ein züchterischer Mehrwert bzw. ein überdurchschnittlicher Anteil qualitativ guter Nachkommen zu erwarten (Baier et al. 2017, Šeho et al. 2023).
Bestand bei Marktoberdorf
Der für das Herkunftsgebiet 805 04 (West- und Süddeutsches Bergland sowie Alpen und Alpenvorland) zugelassene und im Erntezulassungsregister (EZR) gelistete Moorbirken-Saatguterntebestand bei Marktoberdorf besitzt eine Gesamtfläche von 6,5 ha und eine auf die Moorbirke reduzierte Fläche von 3 ha. Der Bestand wird auch von der DKV – Gütegemeinschaft für forstliches Vermehrungsgut e.V. – als DKV-Sonderherkunft »Vorallgäu« geführt (EZR 2023) und regelmäßig beerntet. Dabei handelt es sich um einen im Mittel lichten (geschlossenen bis lückigen), mehrschichtigen und damit strukturreichen Moorbirken-Fichten-Mischbestand mit einer üppigen Strauchflora im Unterstand. Die Stammdimensionen reichen von unter der Derbholzgrenze bis hin zum mittleren Baumholz, mit dem Schwerpunkt beim Stangen- und schwachen Baumholz. Die Bestandesqualität (Stammform, Beastung) und die Vitalität sind gut. Beim Standort handelt es sich sehr wahrscheinlich um einen gestörten Moorstandort. Darauf deuten der am Nordrand vorbeilaufende, wasserführende Graben und mehrere gerade, stufenförmige Höhenunterschiede der Bodenoberfläche im Bestand hin. Letztere könnten alte Torfstiche (Torfstichkanten) darstellen.
Bestand bei Benediktbeuern
Der beprobte Moorbirken-Bestand ist ein nach dem Forstvermehrungsgutgesetz (FoVG) zugelassener Saatguterntebestand für die Moorbirke (Herkunftsgebiet 805 04), einer von derzeit nur zwei in Bayern. Der Saatguterntebestand hat eine Gesamtfläche von 5,9 ha und eine reduzierte Fläche (bezogen auf die Moorbirke) von 2,7 ha (EZR 2023).
Der Moorbirken-Bestand bei Benediktbeuern ist strukturreich: Es gibt sowohl dichtere, als auch sehr lichte Waldbereiche. Die Alters- und Vitalitätsspreite ist groß (junge bis ältere Moorbirken; gesunde bis alters- und standortsbedingt absterbende Moorbirken). Der Bestand zeichnet sich dabei durch sehr gute Stammformen aus. Anhand der Rinde, der Kronenstruktur und der jungen Triebe/Zweige ließ sich vermuten, dass es sich um einen fast reinen Moorbirken-Bestand handelt, was die genetische Untersuchung dann auch bestätigte. Die mit Wasser gefüllten Gräben in und um den Bestand herum, zeugen davon, dass das Gebiet in früherer Zeit entwässert wurde, wovon regelmäßig der Waldbestand profitiert (Schauer 1985). Vermutlich wird die Anzahl der Moorbirken durch die Renaturierung / Wiedervernässung des Moores wieder (auf ein natürliches Maß) zurückgehen und die jüngeren Bäume auch nicht mehr so hoch wachsen, wie die jetzigen Altbäume. Nach Schauer (1985) nehmen die Baumhöhen hin zum Inneren des Hochmoores ab. Außerdem fällt auf, dass zumindest stellenweise Schilf wächst. Da es in dem Saatguterntebestand viele und auch junge Moorbirken gibt, sowie der Moorwasserspiegel wieder ein höheres bzw. naturnäheres Niveau erreicht hat, besitzt das Moorbirken-Vorkommen eine gute Erhaltungsfähigkeit. Eine naturschutzfachliche Besonderheit des Bestandes ist neben dem Sonderstandort »Moor« das dortige Biber-Vorkommen. Davon zeugen zahlreiche von ihm gefällte oder angenagte Bäume sowie deren Äste.

Abb. 5: Möglicher Plusbaum der Moorbirke im Saatguterntebestand Benediktbeuern. (© M. Seho)
Bestand im Nationalpark Bayerischer Wald
Das Moorgebiet Klosterfilz liegt östlich von Riedlhütte in der Kernzone des Nationalparks Bayerischer Wald auf einer Höhenlage von ca. 740 – 750 m. Das Moorgebiet ist etwa 45 ha groß und liegt in einer Talmulde, nach (Nord-)Westen begrenzt durch den kleinen Fluss Große Ohe und nach Süden durch den Grabenwiesbach. Im Osten begrenzt ein deutlicher Geländeanstieg das Moorgebiet. Die Jahresdurchschnittstemperatur liegt hier bei 6,4 – 6,6 °C und der mittlere Jahresniederschlag bei 1100 – 1200 mm. An fünf bis sechs Monaten im Jahr liegt Schnee. Anders als bei den anderen beiden Beständen, handelt es bei diesem Moorbirken-Vorkommen nicht um einen zugelassenen Saatguterntebestand, er liegt umgekehrt jedoch im Herkunftsgebiet 805 03 (Südostdeutsches Hügel- und Bergland) (BayWIS 2023). In den Randbereichen der Fläche dominieren Moorwälder mit Moorbirke, Moorkiefer (Pinus rotundata LINK) und Fichte. Im Zentrum finden sich baumfreie Zonen mit diversen Torfmoos-Arten sowie Bulten- und Schlenkengesellschaften. Die Moorbirken stehen einzeln bis truppweise, teilweise weit verstreut in unterschiedlichen Altersstadien (15- bis 70-jährig), oft auch gemischt mit Fichte und Moorkiefer. Die Moorbirken weisen eine typische Kronenstruktur (nicht oder nur geringfügig überhängende Zweige) (Hegi 1981) auf und erreichen Baumhöhen von bis zu 20 Metern. Die Stamm- und Kronenformen sowie die Vitalität sind als durchschnittlich zu bewerten. Eine Erschließung mit Wegen fehlt weitgehend. (Geiger 2023, Topographische Karte 1:25.000, Topographische Karte als 2. Quelle für Beschreibung der Erschließung verwendet.)

Abb. 6: Eine Moorbirke im Klosterfilz im Nationalpark Bayerischer Wald. (© J. Geiger)
Genetik
Bei der Zulassung von Baumarten, die hybridisieren können (z. B. Stiel- und Traubeneiche, Sand- und Moorbirke), ist eine Beimischung der jeweils anderen Art im Erntebestand und in seiner Umgebung zulässig, soweit es sich nicht um schlecht veranlagte Individuen oder Bestände handelt. Laut Empfehlung des gemeinsamen Gutachterausschusses (gGA), sollte ein Anteil von bis zu 20 % der jeweils anderen Art in einem Erntebestand nicht überschritten werden. Daher sind Einblicke in die Artenzusammensetzung bei den Beständen der Moorbirke notwendig. Zudem soll die genetische Vielfalt der Bestände, die zur Gewinnung von Saatgut herangezogen werden, möglichst hoch sein.
Zu einer ersten Einschätzung wurden drei natürliche Bestände und eine Samenplantage beprobt. Aus den Blatt- bzw. Knospenproben wurde die DNA nach der CTAB-Methode (Doyle und Doyle 1990) extrahiert. Der DNA-Gehalt wurde stichprobenmäßig mit einem Photometer gemessen und die DNA auf ca. 20 ng/µl verdünnt. Im Anschluss wurde eine DNA-Analyse durchgeführt. Dabei kamen hochvariable Kernmikrosatelliten-Marker zum Einsatz. Die DNA wurde anschließend in einer PCR-Reaktion vervielfältigt. Die Auftrennung der DNA-Fragmente erfolgte mittels vollautomatischer Kapillarelektrophorese (GeXP 8800, Beckman-Coulter, ABSciex).
Insgesamt wurden acht gut auswertbare Marker für die Analyse verwendet: L022, L7.8, L7.3, L63, L5.4, L3.1, L1.10 und L13.1 (Kulju et al. 2004). Sie sind für die Routine-Analyse bei Sand- und Moorbirke einsetzbar. Alle 189 Birken-Proben wurden an diesen acht Genorten erfolgreich genetisch analysiert.
Da die Moorbirke tetraploid ist, müssen teilweise spezielle Softwarepakete und damit andere Parameter verwendet werden als bei diploiden Baumarten. Ausgehend von den für die Einzelbäume bestimmten Multilocus-Genotyp wurden zuerst die Allelhäufigkeiten und daraus folgende Parameter berechnet, die die genetische Variation innerhalb der Vorkommen beschreiben. Der genetische Abstand wurde bei der Moorbirke nach dem paarweisem Distanzwert nach Jost (2008) berechnet (R-Paket »Polysat«, Clark and Jasieniuk 2011).
Tabelle 2: Übersicht der Saatgutmengen von gereinigtem Saatgut nach Jahr und Kategorie in Bayern (BLE 2022); (*West- und Süddeutsches Bergland sowie Alpen und Alpenvorland, **Südostdeutsches Hügel- und Bergland)| Baumart | Jahr | Kategorie | Herkunftsgebiet | Bundesland | Samen [kg] |
|---|
| Betula pubescens | 2003 | ausgewählt | 805 04 * | Bayern | 22,0 |
| Betula pubescens | 2003 | qualifiziert | 805 04 * | Bayern | 34,0 |
| Betula pubescens | 2005 | ausgewählt | 805 04 * | Bayern | 16 |
| Betula pubescens | 2006 | ausgewählt | 805 04 * | Bayern | 64,8 |
| Betula pubescens | 2008 | ausgewählt | 805 04 * | Bayern | 64,4 |
| Betula pubescens | 2010 | qualifiziert | 805 04 * | Bayern | 55,0 |
| Betula pubescens | 2011 | ausgewählt | 805 04 * | Bayern | 35,7 |
| Betula pubescens | 2012 | geprüft | 805 03 ** | Bayern | 144,3 |
| Betula pubescens | 2014 | ausgewählt | 805 04 * | Bayern | 20,8 |
| Betula pubescens | 2014 | geprüft | 805 03 ** | Bayern | 47,2 |
| Betula pubescens | 2015 | ausgewählt | 805 04 * | Bayern | 14,8 |
| Betula pubescens | 2018 | ausgewählt | 805 04 * | Bayern | 93,6 |
| Betula pubescens | 2020 | ausgewählt | 805 04 * | Bayern | 54,5 |
Tabelle 3a: Empfohlenes Vermehrungsgut der Moorbirke in Bayern, 805 03 Südostdeutsches Hügel- und Bergland| Bisher bewährte Herkünfte | | | |
| EB des HKG 805 03 | | | ausgewählt |
| Klimaplastische Herkünfte | | | |
| SP Drömling-Reinhardshagen | Hessen | Register-Nr. 062805 04 002 4 | geprüft |
| SP Drömling-Wehretal | Hessen | Register-Nr. 062805 04 002 4 | geprüft |
| SP Liebenburg | Niedersachsen | Register-Nr. 034 805 02 001 3 | qualifiziert |
| EB des HKG 805 04 | | | ausgewählt |
Tabelle 3b: Empfohlenes Vermehrungsgut der Moorbirke in Bayern, 805 04 West- und Süddeutsches Bergland sowie Alpen und Alpenvorland| Bisher bewährte Herkünfte | | | |
| SP Drömling-Reinhardshagen | Hessen | Register-Nr. 062805 04 002 4 | geprüft |
| SP Drömling-Wehretal | Hessen | Register-Nr. 062805 04 002 4 | geprüft |
| EB des HKG 805 04 | | | ausgewählt |
| Klimaplastische Herkünfte | | | |
| SP Oldendorf | Niedersachsen | Register-Nr. 031 805 04 001 3 | qualifiziert |
| SP Harzhochlagen | Niedersachsen | Register-Nr. 031 805 04 002 3 | qualifiziert |
| SP Liebenburg | Niedersachsen | Register-Nr. 062 805 04 002 4 | qualifiziert |
| EB des HKG 805 03 | | | ausgewählt |
Die Berechnung der Diversitätsmaße (Na – Anzahl der Allele, Npriv – private Allele, Shannons Diversitätsindex) und des genetischen Abstands (paarweiser JostD, Jost 2008) erfolgte in R (Paket »Polysat« (Clark and Jasieniuk 2011). Die Hauptkomponentenanalyse »Principal Component Analysis« (PCA) wurde genutzt, um die genetischen Muster nach der genetischen Distanzmatrix nach Bruvo darzustellen (Bruvo et al. 2004). Darüber hinaus wurde eine Bayes’sche Clusteranalyse (Software STRUCTURE (Pritchard et al. 2000) benutzt und mittels der Software CLUMPAK (Kopelman et al. 2015) entsprechend grafisch visualisiert.
Artunterscheidung zwischen Moorbirke und Sandbirke
 Zoombild vorhanden
Zoombild vorhanden
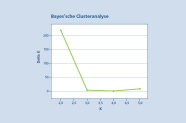
Abb. 7: Ergebnis Bayes’schen Clusteranalyse zur Erkennung der wahrscheinlichsten Gruppierung innerhalb des untersuchten Genpools. Es werden eindeutig zwei Gruppen (K=2) bei dem höchsten Wert (deltaK=217) identifiziert. (© LWF)
Die Artbestimmung bei den Birken ist teilweise schwierig, weil sporadisch in beschränktem Umfang Hybridisierung auftritt. Neben der Unterscheidung durch morphologische Merkmale, haben sich in den letzten Jahren molekulargenetische Methoden etabliert, die eine Artunterscheidung auf der Ebene des Individuums und der Population ermöglichen. Durch statistische Verfahren können Individuen eines Mischbestandes den jeweiligen Arten zugeordnet und mögliche Hybride festgestellt werden.
Zudem ist die Differenzierung zwischen Sand- und Moorbirke auch auf der Ebene des Individuums teilweise auf Grundlage der Ploidie (= Anzahl der Chromosomensätze) möglich. Da es sich bei der Sandbirke um eine diploide Art (mit doppeltem Chromosomensatz) und bei der Moorbirke um eine tetraploide Art (mit vierfachem Chromosomensatz) handelt, sind für erstere maximal zwei verschiedene Allele pro Genort und für letztere maximal vier verschiedene Allele pro Genort möglich. Aufgrund der Anzahl von Allelen eines Individuums können Rückschlüsse auf die Art gezogen werden. Wenn ein Genort drei oder vier unterschiedliche Allele aufweist, handelt es sich um eine Moorbirke. Bei zwei oder weniger unterschiedlichen Allelen kann es eine Moor- oder Sandbirke sein. Daher ist die alleinige Anwendung der Ploidie-Auswertung für die Bestimmung der Moorbirke nicht geeignet, da bei zwei Allelen nicht direkt auf Moorbirke geschlossen werden kann.
Eine Sandbirken-Population wurde in einem ersten Schritt als Referenzbestand zur Artunterscheidung hinzugezogen. Mithilfe der Software STRUCTURE 2.3.3 wurde eine Bayes‘sche Clusteranalyse der fünf Vorkommen durchgeführt. Die Ergebnisse zeigten eine eindeutige Gruppierung bei einem K-Wert von zwei (Abbildung 7). Dabei werden die beiden Birkenarten eindeutig in zwei Cluster getrennt (Abbildung 8). Ein Cluster wird von der Moorbirke (blau) und ein zweites Cluster von der Sandbirke (orange) gebildet. Für jedes Individuum ist die Zuordnungswahrscheinlichkeit zu einer der beiden Arten in der Abbildung 8 als vertikale Linie grafisch dargestellt. Im Bestand Benediktbeuern und der Samenplantage Laufen-Lebenau zeigen sich deutliche Anzeichen von Sandbirke in zwei bzw. fünf Einzelbäumen. In diesen Individuen findet sich ein hoher Anteil der Sandbirke. Diese Bäume sollten entnommen werden. Bei den anderen beiden Beständen liegt der Anteil der Sandbirke auf Populationsebene unter 3 %, zudem zeigt keiner der untersuchten Bäume einen überwiegenden Anteil an Sandbirke.
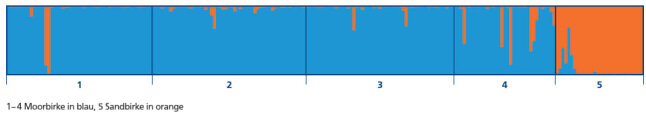
Abb. 08: Artunterscheidung der Moor- und Sandbirke anhand der Bayes'schen Clusteranalyse.
Genetische Vielfalt innerhalb der Moorbirke
Die genetische Charakterisierung soll einen Überblick über die genetische Variabilität ermöglichen, sowie räumlich-genetische Muster in Bayern aufzeigen. Daraus sollen Empfehlungen für Maßnahmen zur Erhaltung dieser bedrohten Baumart abgeleitet werden. Die im Labor des AWG getesteten Marker wurden erstmals für eine populationsgenetische Untersuchung der Moorbirke in Bayern eingesetzt. Da die Moorbirke eine tetraploide Baumart ist, ist die Bewertung ihrer genetischen Variation und Struktur nicht so einfach wie bei diploiden Baumarten.
Aus diesem Grund stellen wir hier erste Ergebnisse der genetischen Variationsstudie der Moorbirke in Bayern vor. Die Anzahl der Allele (Na) schwankte zwischen 15,5 (C-Marktoberdorf) und 18,0 (B-Kloster-filz) mit einem Gesamtdurchschnitt von Na = 16,3. Die höchste Anzahl an privaten Allelen wurde im Bestand B-Klosterfilz (Npriv = 13) gefunden bei einem Gesamtdurchschnitt von Npriv = 6,8 (Tabelle 4). Der Shan-non-Index für die genotypische Diversität ist in den untersuchten Beständen sehr ähnlich.
Tabelle 4: Übersicht der genetischen Variationsparameter für die analysierten Vorkommen im Vergleich.| Population | N | Na | Npriv | SI |
|---|
| A-Benediktbeuern | 50 | 16,1 | 5 | 3,91 |
| B-Klosterfilz, NP Bayer. Wald | 53 | 18,0 | 13 | 3,97 |
| C-Marktoberdorf | 51 | 15,5 | 4 | 3,93 |
| D-SPL Laufen-Lebenau | 35 | 15,8 | 5 | 3,32 |
Die Ergebnisse der genetischen Distanz wurden anhand des paarweisen genetischen Abstands basierend auf Jost D berechnet und in Tabelle 5 dargestellt. Die drei untersuchten Populationen (A – C) und die Samenplantage weisen eine mittlere genetische Distanz auf. Besonders der paarweise genetische Abstand zwischen dem Bestand A-Benediktbeuern und der Samenplantage fällt dabei auf.
Tabelle 5: Paarweiser genetischer Abstand basierend auf Jost D (JOST 2008) (R-Paket)| | PopA | PopB | PopC |
|---|
| PopB | 0,063 | | |
|---|
| PopC | 0,065 | 0,046 | |
|---|
| PopD | 0,084 | 0,056 | 0,074 |
|---|
Die Bayes’sche Clusteranalyse mit der Software STRUCTURE 2.3.3 ergab eine mögliche Struktur von drei und vier genetischen Clustern. Dabei wurde der größte Wert für deltaK bei K = 3 (deltaK = 19) erreicht und der nächstgrößere Wert bei K = 4 (deltaK = 12,5). Bei vier Clustern trennt sich die Population A-Benediktbeuern in zwei Untergruppen auf. Die anderen Populationen zeigen eine ziemlich gleiche Verteilung der drei Cluster (Abbildung 9). Auffällig ist das grüne Cluster in der Samenplantage, der in den untersuchten Beständen nur sehr gering ist.
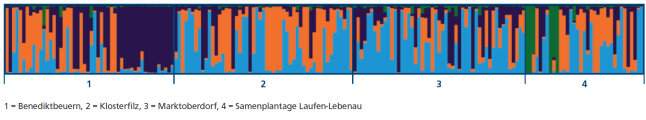
Abb. 9: Ergebnis der Bays'eschen Clusteranalyse bei den Birken von drei Beständen und einer Samenplantage bei vier Gruppen. (© LWF)
Die Hauptkomponentenanalyse (PCA) zeigt die genetischen Hauptmuster, die in der genetischen Distanzmatrix nach Bruvos genetischem Abstand (Bruvo et al. 2004) enthalten sind (Abbildung 10). Die Birken der Samenplantage zeigen dabei die größte Streuung. Zwei Ausreißer sind bei der Population A (Benediktbeuern) zu erkennen.
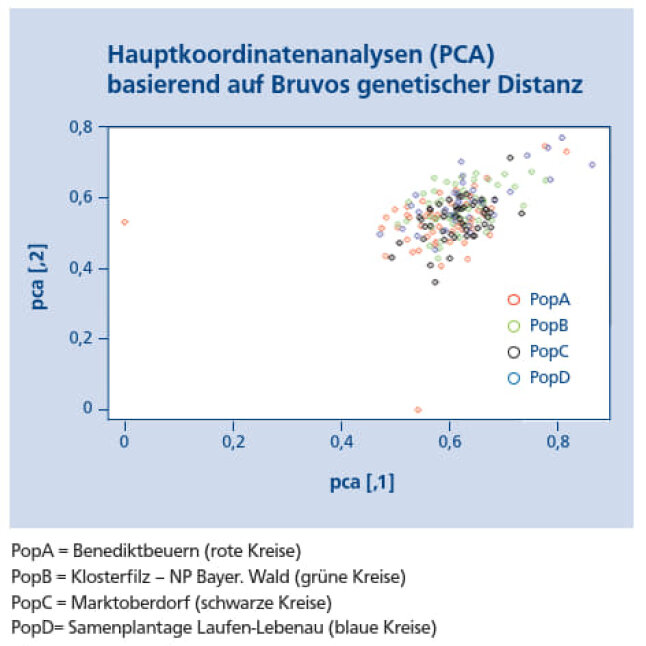
Abb 10: Hauptkomponenten-Analyse (PCA) basierend auf dem genetischen Abstand nach Bruvo (Bruvo et al. 2004) (© LWF)
Schlussfolgerungen
Die Prüfung auf Artzugehörigkeit ist mittels genetischer Marker bei der Birke sehr gut möglich. Damit können beispielsweise zugelassene Saatguterntebestände auf vorhandene Artanteile geprüft werden. Anhand der Ergebnisse lassen sich eindeutig zwei Arten definieren. Dabei werden die beiden Birkenarten (Moor- und Sandbirke) eindeutig in zwei Cluster getrennt. Eine weitere Art oder Unterart konnte nicht differenziert werden. Im Bestand Benediktbeuern und der Samenplantage Laufen-Lebenau zeigen sich zudem deutliche Anzeichen von Sandbirke in zwei bzw. fünf Individuen. Die drei untersuchten Moorbirkenbestände enthalten insgesamt geringe Anteile der Sandbirke. Sie liegen deutlich unter 20 %. Die drei untersuchten Populationen (A – C) und die Samenplantage weisen eine mittlere genetische Distanz zueinander auf.
Die genetische Vielfalt von Erntebeständen sollte möglichst hoch sein, um eine hohe Anpassungsfähigkeit des Saat- und Pflanzgutes zu gewährleisten. Die empfohlenen Bestände sollten eine hohe genetische Diversität sowie eine hohe Anzahl an Allelen aufweisen. Der Bestand »Klosterfilz« im Nationalpark Bayerischer Wald zeigt die höchsten Werte bei der Allelzahl (Na = 18,0) und bei den privaten Allelen (Npriv = 13). Aus den Ergebnissen lässt sich ableiten, dass alle drei untersuchten Bestände aus genetischer Sicht als Saatgutquelle empfohlen werden können.
Bei einer günstigen Kombination der genetischen Diversität und der Allelzahl kann bei einer Auswahl von mindestens 30 Bäumen, die über das ganze Vorkommen verteilt sind, eine hohe genetische Vielfalt im Saatgut gewährleistet werden. Es wird empfohlen, bevorzugt Saatguterntebestände auszuweisen, die auf einer größeren Fläche (min. 0,5 ha reduzier-te) stocken und eine gute räumlichen Verteilung der Moorbirken aufweisen. Bei der Moorbirke ist durch das FoVG keine Mindestfläche vorgegeben. Es kann beobachtet werden, dass in der Regel bei allen größeren Beständen (wie z. B. Klosterfilz) die genetischen Vielfaltsparameter überdurchschnittlich abschneiden. Des Weiteren sollte die Anzahl der zu beerntenden Bäume bei Nebenbaumarten erhöht werden. Gerade bei Nebenbaumarten, bei denen keine großen Bestände vorhanden sind und der Genfluss zwischen den Beständen kaum vorhanden ist, sollten mindestens 30 Bäume einer Waldpopulation beerntet werden. Bei der Moorbirke ist nach FoVG die Mindestbaumzahl von 20 Bäumen im Bestand, 10 davon sind für die Ernte vorgeschrieben, aus genetischer Sicht zu gering.
Die untersuchte Samenplantage Laufen-Lebenau zeigt durchschnittliche Werte bei den genetischen Variationsparametern. Durch die Auswahl und Anzahl der Klone aus denen eine Samenplantage zusammengestellt wurde, wird die genetische Vielfalt beeinflusst. In neueren Samenplantagen mit einer sehr hohen Anzahl an Klonen (60 und mehr), die aus unterschiedlichen Beständen stammen, wird eine deutlich höhere genetische Vielfalt beobachtet als in natürlichen Beständen (Bsp. Elsbeere mit 96 Klonen, Baier et al. 2017). Zum Vergleich beim Feldahorn (Klonanzahl eher niedrig mit 46 Klonen) ist die genetische Vielfalt geringer und liegt im Bereich eines natürlichen Bestandes (Fussi et al. 2021). Somit kann für die Moorbirke empfohlen werden, die Klonanzahl möglichst zu erhöhen und eine vollständige Beerntung der Plantage durchzuführen. Gerade bei seltenen Baumarten ist der Aufbau von Erhaltungsplantagen eine wichtige Maßnahme und kann zur Sicherung forstlicher Genressourcen und zur Versorgung mit hochwertigem Vermehrungsgut beitragen. Daneben ist eine Rationalisierung der Ernte möglich, die in den Beständen schwer durchführbar ist und dadurch die Moorstandorte auch oft nicht beerntet werden.
Ausblick
Um eine genauere Aussage zu räumlich-genetischen Strukturen treffen zu können, sollten mindestens weitere zehn Bestände aus allen relevanten Vorkommen genetisch charakterisiert werden. Ziel ist die Erhaltung des lokalen oder regionalen Genpools im Rahmen von Bewirtschaftungs- oder Renaturierungsmaßnahmen in und um Moore herum. Damit dieses Ziel erreicht werden kann, sollten folgende Arbeiten umgesetzt werden.
- Überprüfung der Herkunftsgebiete der Moorbirke (ggf. Neuvorschläge) und Erarbeitung von Herkunfts- und Verwendungsempfehlungen für die Moorbirke, jeweils auf genetischer Grundlage (insbesondere der regionalen Differenzierung).
- Gesamtbewertung der Untersuchungsbestände hinsichtlich der Kriterien Erhaltungswürdigkeit, -dringlichkeit und -fähigkeit sowie Auswahl von Generhaltungsbeständen im Rahmen der Umsetzung des Bayerischen Generhaltungskonzepts unter Berücksichtigung der genetischen Erkenntnisse (u. a. genetische Vielfalt)
- Verbesserung der Erntebasis zur Deckung des zukünftigen Bedarfs an Vermehrungsgut durch Empfehlung weiterer Moorbirken-Saatguterntebestände für die Zulassung nach FoVZV.
Danksagung
Unser Dank gilt Andreas Ludwig (Leiter BaySF-Pflanzgarten Stützpunkt Laufen), der seine Expertise und jahrzehntelange Erfahrung im Forstsaatgutwesen zu diesem Artikel beigesteuert hat, sowie Johann Geiger (AWG), der den Moorbirkenbestand im Nationalpark beprobt und beschrieben hat. Für die zügige Durchführung der genetischen Analysen danken wir Roswitha Jenner und Susanne Nowak. Des Weiteren danken wir Dr. Stefan Müller-Kroehling, der als Moorexperte der FoV dem AWG eine Liste bedeutsamer Moorbirken-Bestände in Bayern zur Verfügung gestellt hat.
Literatur
- Ashburner, K.; McAllister, H.A. (2013): The genus Betula: a taxonomic revision of birches. London: Kew Publishing
- Atkinson, M.D. (1992): Betula pendula ROTH (B. verrucosa EHRH.) and B. pubesecens EHRH. - Biological Flora of the Brithish Isles. J. Ecol. 80, 837 - 870.
- Baier, R.; Fussi, B.; Kavaliauskas, D.; Gruber, K.; Günzelmann, G.; Paulus, A.; Lang, E.; Luckas, M.; Wieners, M.; Schmid, R.; Kon-nert, M. (2017): Die Elsbeere - Generhaltung und Herkunftsfragen. AFZ/Der Wald 20, 14 - 18.BayWIS (Bayerisches Waldinformationssystem) (2023)
- Bayerisches Landesamt für Digitalisierung, Breitband und Vermessung: Amtliche Topographische Karte 1 : 25 000. ATK25-J19 Grafenau
- BayWIS (2023): Bayerisches Wald-Informationssystem. GIS-Programm der Bayerischen Forstverwaltung
- Bruvo, R.; Michiels, N.K.; D’Souza, T.G.; Schulenburg, H. (2004): A simple method for the calculation of microsatellite genotype distances irrespective of ploidy level. Molecular ecology, 13(7), 2101 - 2106.
- Burkart, A. (2018): Kulturanleitungen für Waldbäume und Wild-sträucher. Anleitungen zur Samenernte, Klengung, Samenlagerung und Samenausbeute sowie zur Anzucht von Baum- und Straucharten. WSL Ber. 63: 104 S.
- Caudullo, G.; Welk, E.; San-Miguel-Ayanz, J. (2017): Chorological maps for the main European woody species. Data in Brief 12: 662 - 666. DOI: 10.1016/j.dib.2017.05.007. https://www.euforgen. org/species/
- Clark, L.V.; Jasieniuk, M. (2011): POLYSAT: an R package for polyploid microsatellite analysis. Molecular Ecology Resources, 11(3), 562 - 566.
- Dellinghausen, M. von; Stern, K. (1958): Über einige besondere Blütenformen der Birke. Silvae Genetica 7, 181 - 188.
- Doyle, J.J. and Doyle, L.J. (1990): Isolation of plant DNA from fresh tissue, Focus 12: 13 - 15.
- Earl, D.A.; Von Holdt, B.M. (2012): STRUCTURE HARVESTER: a website and program for visualizing STRUCTURE output and implementing the Evanno method. Conservation Genetics Resources 4, 359 - 361.
- EZR (Erntezulassungsregister) (2023): https://www.stmelf.bay-ern.de/ezr/suche.do?method=search1 (Zugriff am 28.03.2023)
- Fussi, B.; Rau, B.; Kavaliauskas, D.; Šeho, M. (2021): Verbesserung der Erntebasis beim Feldahorn. AFZ/Der Wald 8, 18 - 21.
- Geiger, J. (2023): Interne Mitteilung per E-Mail vom 17.03.2023 Hegi, G. (1981): Illustrierte Flora von Mitteleuropa. Vol. III. München.
- Hibsch-Jetter, C. (1997): Betula pubescens Ehrhart, 1791. In: Schütt et al.: Enzyklopädie der Holzgewächse. Handbuch und Atlas der Dendrologie. ecomed, 8. Erg.Lfg 6/97
- Hjelmroos, M. (1991): Evidence of Long-Distance Transport of Betula Pollen. Grana 30, 215 - 228.
- ISTA (International Seed Testing Association) (2020): International Rules for Seed Testing 2020. Introduction to the ISTA Rules Chapters 1 - 19, https://doi.org/10.15257/istarules.2020.F
- Jenner, R. (2023): Saatgutprüfung und Einflussfaktoren. Mündliche Mitteilung 03.03.203
- Johnsson, H. (1974): Genetic Characteristic of Betula verucosa EHRH. and B. pubescens EHRH. Annales Forestales 6, 87 - 151.
- Kleinschmit, J. (1998): Die Birke - Standortansprüche und Möglichkeiten der züchterischen Verbesserung. Forst und Holz 53: 93 - 104.
- Kleinschmit, J.; Otto, H.-J. (1980): Prüfung von Birkenherkünften und Einzelbäumen sowie Züchtung mit Birke. Der Forst- und Holzwirt 35: 81 - 90.
- Kleinschmit, J.; Svolba, J. (1982): Prüfung von Birkenherkünften und Einzelbäumen - erste Ergebnisse der Feldversuche. Der Forst- und Holzwirt 37: 257 - 263.
- Kleinschmit, J.; Svolba, J. (1983): Prüfung von Birken-Herkünften und Einzelbäumen durch die Abt. Forstpflanzenzüchtung der Niedersächsischen Forstlichen Versuchsanstalt. Die Holz-zucht: 14 - 17.
- Kopelman, N.M.; Mayzel, J.; Jakobbson, M.; Rosenborg, N.A.; Mayrose, I. (2015): Clumpak: a program for identifying clustering modes and packaging population structure inferences across K. Molecular ecology resources, 15(5), 1179 - 1191.
- Kulju, K.K.M.; Pekkinen, M.; Varvio, S. (2004): Twentythree microsatelliteprimer pairs for Betula pendula (Betulaceae). Mol Ecol Notes 4, S. 471 - 473.
- Kuneš, I.; Linda, R.; Fér, T.; Karlík, P.; Baláš, M.; Ešnerová, J. et al. (2019): Is Betula carpatica genetically distinctive? A morphometric, cytometric and molecular study of birches in the Bohemian Massif with a focus on Carpathian birch. PLoS ONE 14(10): e0224387. https://doi.org/10.1371/journalpone.0224387
- Longman, K.A. (1984): Physiological Studies in Birch. Proc. Royal Soc. Edinb. 85B, 97 - 113.
- Ludwig, A. (2023): Erfahrungen eines Praktikers rund um das Thema Birken-Saatgut und Birken-Anzucht. E-Mail vom 15.03.2023
- LWF (Bayerische Landesanstalt für Wald und Forstwirtschaft, Hrsg.) (2017): Freisaaten im Wald. Merkblatt der Bayerischen Landesanstalt für Wald und Forstwirtschaft, Nr. 37, August 2017
- Morgenthaler, H. (1915): Beiträge zur Kenntnis des Formenkrieses der Sammelart Betula alba L. Dissertation, Zürich.
- Müller-Kroehling, S. (2006): Natura 2000 im Wald. AFZ 18, S. 978 - 979.
- Perala, D.A.; Alm, A.A. (1990): Reproductive Ecology of Birch: A Review. Forest Eco. Manage. 32, 1 - 38.
- Pritchard, J. K.; Stephens, M.; Donelly, P. (2000): Inference of population structure using multilocus genotype data. Genetics, 155(2), S. 945 - 959.
- Rau, H.-M. (1991): Erfahrungen mit Provenienzen und Hybriden verschiedener Birkenarten. Die Holzzucht 45: 17 - 24.
- Rau, H.-M. (2003): Erfahrungen mit nordamerikanischen und europäischen Birkenarten. AFZ/Der Wald 58: 792 - 794.
- Reiss, G. (2023): Beantwortung einiger Fragen zur Saatgut-behandlung und Nachzucht bei der Moorbirke. E-Mail vom 28.03.2023
- Rohmeder, E. (1950): Samenmenge und Saatzeit bei Gründung des Birkenvorwaldes. Allgemeine Forstzeitschrift 5, 91 - 96.
- Schauer, T. (1985): Zur Vegetation einiger Hoch- und Übergangsmoore im bayerischen Alpenvorland. Teil I. Moore im nördlichen Pfaffenwinkel
- Scholz, E. (1972): Zur introgressiven Hybridisierung von Betula pendula ROTH and B. pubescens EHRH. Beitr. f.d. Forstwirtsch., 11 - 15.
- Šeho, M.; Fussi, B.; Schirmer, R.; Hamberger, J.; Janßen, A. (2023): Neue Herkunfts- und Verwendungsempfehlungen in Bayern. Liesebach, M. (ed.) Beiträge von Forstpflanzenzüchtung und Forstgenetik für den Wald von Morgen: 7. Tagung der Sektion Forstgenetik/Forstpflanzenzüchtung. Tagungsband. Braun-schweig: Johann Heinrich von Thünen Institut, 318 p, Thünen Report 105, DOI:10.3220/REP1681451577000, 282 - 297.
- Schönborn, A.v. (1964): Die Aufbewahrung des Saatgutes der Waldbäume. BLV, München, Basel, Wien.
- Schubert, J. (1998): Lagerung und Vorbehandlung von Saatgut wichtiger Baum- und Straucharten. Eberswalde-Finow
- Steiner, W.; Lück, W. (2003): Birkenzüchtung in Niedersachsen. AFZ/Der Wald 58: 795 - 797.
- Suszka, B.; Muller, C.; Bonnet-Masimbert, M. (1994), translated by: Andrew Gordon (1996): seeds of forest broadleaves. from harvest to sowing, Institut national de la recherche agriculture (INRA)
- Wagner, C. (1994): Zur Ökologie der Moorbirke Betula pubescens EHRH. in Hochmooren Schleswig-Holsteins unter besonderer Berücksichtigung von Regenerationsprozessen in Torfstichen. - Mitt. Arbeitsgemeinschaft Geobotanik in Schleswig-Holstein und Hamburg 47: 182 S
Beitrag zum Ausdrucken
Weiterführende Informationen
Autoren



 Zoombild vorhanden
Zoombild vorhanden


 Zoombild vorhanden
Zoombild vorhanden






